2. Bazele chimice ale anatomiei și fiziologiei
Cuprins:
2.1. Introducere2.2. Principii chimice
2.3. Compuși organici
2.1. Introducere
1800 – cercetătorii au remarcat posibilitatea de sintetiza anumiți compuși din alcătuirea organismelor vii;
1828 – a fost sintetizat primul compus – ureea (produs de degradare al metabolismului proteic), de către Friedrich Wöhler. Din acel moment s-a concluzionat corelația fiziologiei organismului cu chimia.
Clasificarea compușilor chimici se face în:
- compuși organici – în organismul uman, cât și în celelalte viețuitoare întâlnim cele 4 tipuri principale, care sunt: glucide, lipide, proteine și acizi nucleici;
- compuși anorganici.
2.2. Principii chimice
Formarea substanțelor organice depinde de modul de legare al atomilor între ei rezultând molecule.
Elementele chimice
Elementul chimic – este o componentă fundamentală care intră (unul sau mai multe elemente) în alcătuirea întregii materii din univers.
Există 92 de elemente chimice în natură. Oamenii de știință au sintetizat și multe altele. Mijloacele chimice nu permit dezintegrarea unui element chimic în alte componente.
Indicațiile elementelor se fac prin simboluri derivate din limba latină (de exemplu, Na – de la natrium, K de la kalium, Fe de la ferrum). Mai mult de 90% din greutatea corpului uman este dată de hidrogen, carbon, oxigen și azot.
O selecție de elemente chimice întâlnite în organismele vii
| Element chimic | Simbol atomic | Masa atomică |
|---|---|---|
| Carbon | C | 12 |
| Hidrogen | H | 1 |
| Oxigen | O | 16 |
| Azot (nitrogen) | N | 14 |
| Sulf | S | 32 |
| Fosfor | P | 31 |
| Potasiu | K | 39 |
| Calciu | Ca | 40 |
| Fier | Fe | 56 |
| Magneziu | Mg | 24 |
| Cupru | Cu | 64 |
| Bor | B | 11 |
| Zinc | Zn | 65 |
| Clor | Cl | 35 |
| Sodiu | Na | 23 |
| Mangan | Mn | 55 |
| Cobalt | Co | 59 |
| Iod | I | 127 |
Atomii
Atomul – unitatea fundamentală din care sunt alcătuite elementele chimice. Reprezintă cea mai mică parte dintr-un element care alături de atomii altor elemente, intră în combinații.
Degradarea unui atom în subunități mai mici nu poate fi făcută fără pierderea proprietăților sale elementare.
Atomii sunt alcătuiți din:
- protoni – masa unui proton încărcat pozitiv depășește masa unui electron încărcat negativ, de circa 1835 ori;
- neutroni (nucleari) – lipsiți de încărcătură electrică; cântărește la fel ca protonul;
- electroni – înconjoară protonii și neutronii și orbitează.
Protonii si neutronii aderă strâns cu scopul de a forma nucleul dens al atomului, încărcat pozitiv. În jurul nucleului se învârt electronii pe trasee denumite straturi.
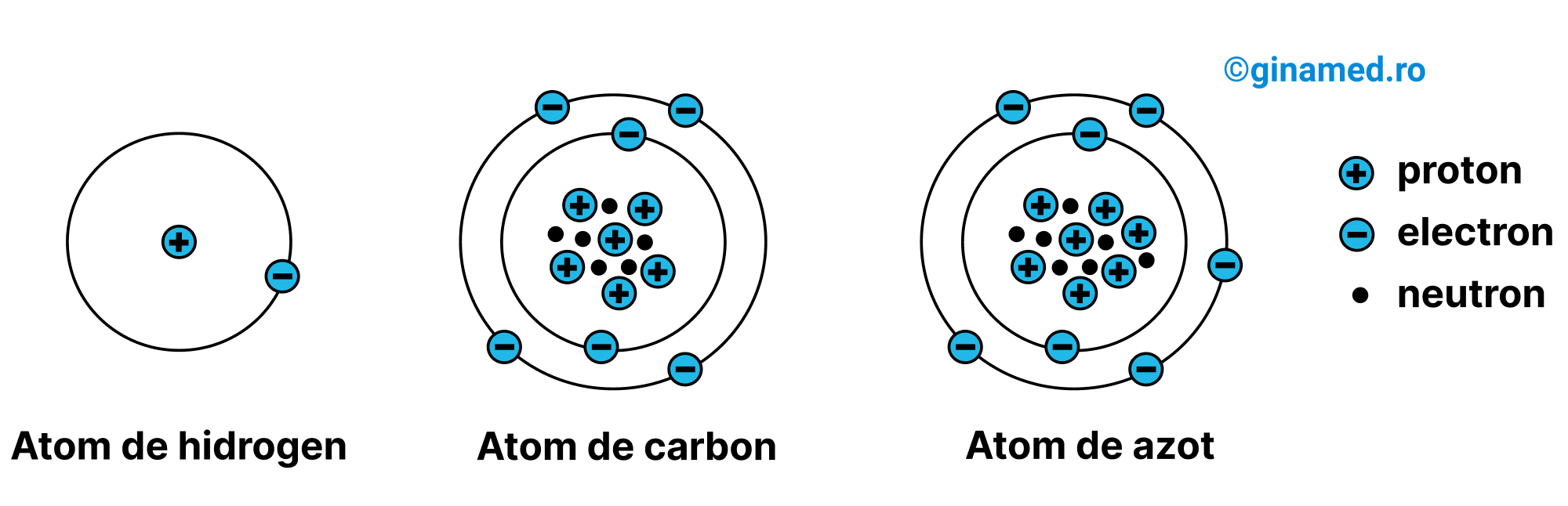
Numărul atomic al unui element constituie numărul de protoni dintr-un atom.
Numărul de masă (masa atomică) al unui element reprezintă suma protonilor și neutronilor din atom.
În funcție de cum sunt distribuiți electronii în atom, aceasta prezintă importanță în chimia atomului. Atomii cu stabilitatea cea mai mare sunt cei care prezintă un număr complet de electroni pe stratul extern, care poate fi de 2 (pentru hidrogen și heliu) sau 8. Tendința unui atom de a primi sau ceda electroni se desfășoară până la completarea stratului extern și atingerea stabilității atomului. Un element în alcătuirea căruia intră atomi care prezintă straturi externe complete, reprezintă un element inert, deoarece nu intră în reacție cu alți atomi. Exemple: heliu, neon, krypton.
Primirea sau cedarea electronilor sunt procese fundamentale pentru reacțiile chimice ale atomilor. O reacție în urma căreia se pierd electroni se numește oxidare. O reacție în urma căreia se primesc electroni se numește reducere. Astfel de reacții se desfășoară împreună și poartă numele de reacții de oxido-reducere.
Atomii compuși dintr-un număr egal de protoni și electroni sunt încadrați ca fiind neutri (neîncărcați). Prin primirea sau pierderea de electroni, capătă încărcătură electrică și devin ioni. Dacă prezintă un proton în plus, atunci ionul are sarcină pozitivă, iar dacă prezintă un electron în plus, ionul are sarcină negativă. Ioni cu importanță în fiziologia umană, sunt: ionii de sodiu, calciu, potasiu și alții.
Moleculele
În funcție de dispoziția atomilor în moleculă, se stabilesc proprietățile.
Masa moleculară este egală cu masa atomică a atomilor din moleculă. De exemplu, apa are masa moleculară 18. Exprimarea masei moleculare se face în daltoni. Un dalton reprezintă masa unui atom de hidrogen. Masa unui atom de hidrogen fiind egală cu 1, atunci un compus care prezintă masa moleculară 18, este de 18 ori mai greu decât un atom de hidrogen. Daltonii oferă o idee relativă privind mărimea unei molecule.
Legarea atomilor unii de ceilalți se face prin intermediul legăturilor chimice. Formarea unei legături presupune apropierea atomilor suficient de mult încât să permită suprapunerea straturilor lor electronice. Ulterior, electronii se schimbă sau se învârt pentru a forma o legătură chimică.
Legăturile chimice se clasifică în:
- legătura ionică – rezultă atunci când electronii unui atom sunt cedați (transferați) unui alt atom, rezultând atomi încărcați electric – ioni. Sarcinile electrice ale celor 2 ioni sunt opuse (+ și -), iar ionii cu sarcini electrice opuse se atrag între ei, formând o legătură ionică. Din punct de vedere al tăriei, legătura ionică este o legătură puternică. De exemplu, NaCl (clorura de sodiu) este alcătuită din ioni de sodiu și clor combinați în acest fel.
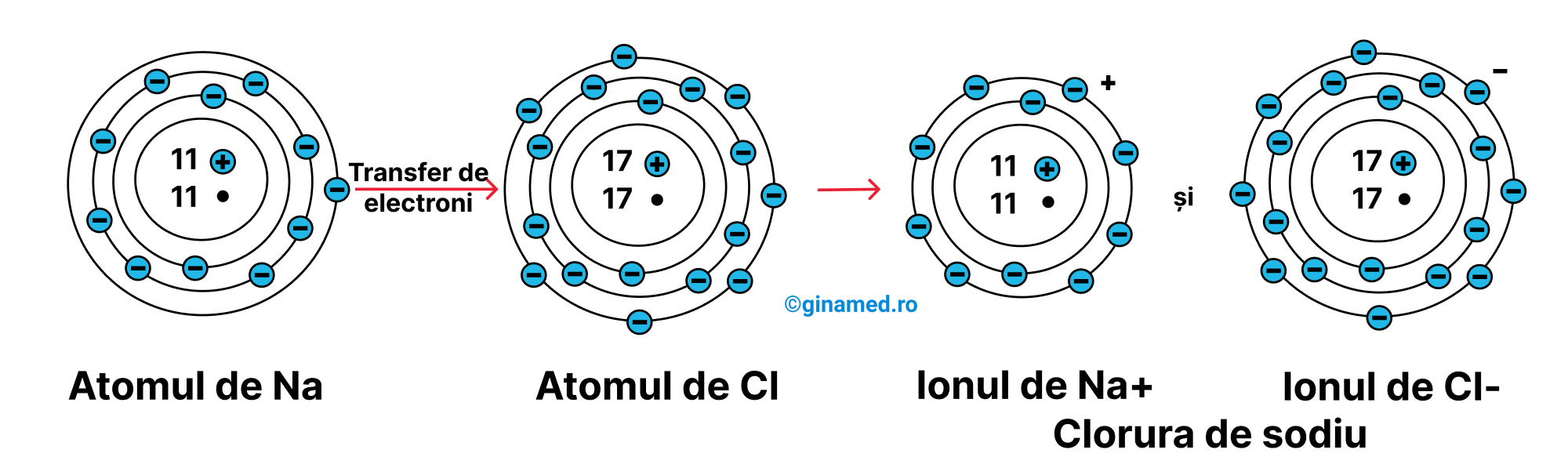
Clorura de sodiu conține o legătură ionică formată prin deplasarea unui electron din atomul de Na la atomul de Cl, rezultând ioni a căror atracție electrică duce la formarea acestui tip de legătură.
- legătura covalentă – rezultă prin punerea în comun a unuia sau mai multor electroni din alcătuirea a 2 atomi. Molecula de metan (CH4) prezintă în alcătuirea ei un atom de carbon care își împarte electronii cu 4 atomi de hidrogen. În cazul moleculei de apă (H2O), atomul de oxigen își împarte electronii cu 2 atomi de hidrogen. Atunci când se împarte o singură pereche de electroni, legătura este simplă, iar când se împart două, legătura este dublă. Din punct de vedere al tăriei, legătura covalentă este o legătură puternică.
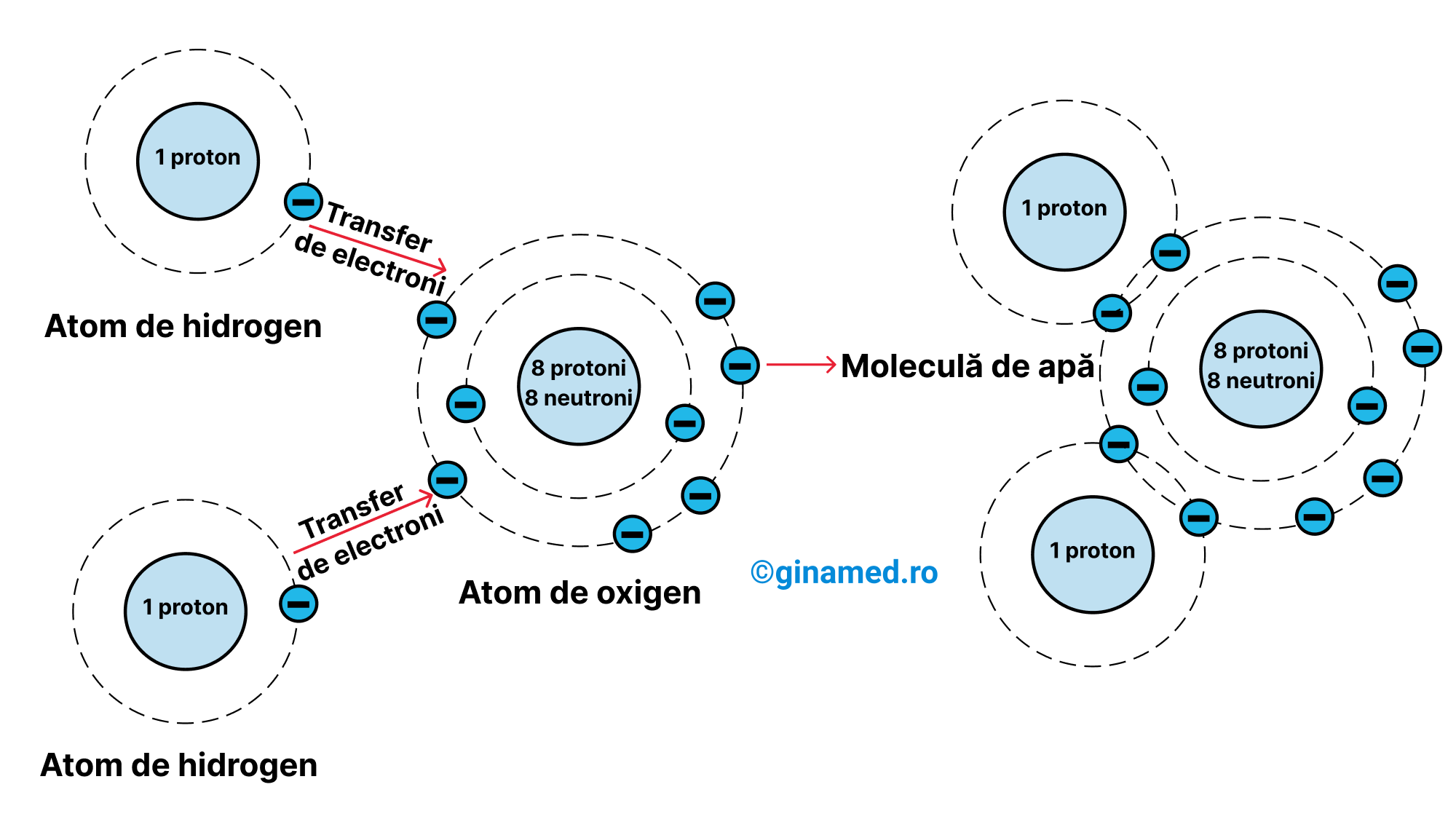
Formarea unei legături covalente într-o moleculă de apă rezultă din punerea în comun a electronilor de pe ultimul strat ai atomului de oxigen cu alți 2 atomi de hidrogen, proces prin care se completează straturile externe ale fiecărui atom.
Stratul extern al atomului de carbon prezintă doar 4 electroni ceea ce îl transformă într-un element renumit pentru abilitatea sa de se implica în numeroase legături covalente. Acesta se poate combina cu alți 4 atomi sau grupuri de atomi. Compușii carbonici posibili sunt foarte diversificați. Astfel, chimia carbonului revine în slujba chimiei umane și a disciplinei de chimie organică.
- legătură de hidrogen – constituie o legătură slabă, rezultată în urma atracției dintre părți ușor pozitive și părți ușor negative ale moleculelor. Legăturile de hidrogen intervin în coeziunea apei, menținând împreună moleculele de apă. Totodată, legăturile de hidrogen se întâlnesc și între componentele acizilor nucleici, ajutând la menținerea structurii de dublu helix a ADN-ului. Și pentru forma tridimensională a proteinelor sunt responsabile, în mare parte, legăturile de hidrogen.
Reacția chimică – reprezintă procesul în urmă căruia substanțele chimice interacționează cu scopul de a forma legături noi.
În cadrul unei reacții chimice, reactanții pot forma variați produși de reacție. De exemplu, dintr-o moleculă reactantă pot rezulta doi produși moleculari în urma divizării ei. În alte situații, se poate realiza un schimb de părți între moleculele reactante, poate fi introdusă apa în reacție și procesul respectiv poartă numele de hidroliză. Sau ar putea apărea o reacție de oxido-reducere care implică un schimb de electroni.
Apa reprezintă un component important din multe reacții chimice, atât ca și compus adăugat reactanților cât și ca moleculă rezultată din reacție. Totodată, apa reprezintă solventul universal în organismul uman. Practic, totalitatea reacțiilor chimice fiziologice se desfășoară în apă. Apa constituie mai mult de 75% din alcătuirea organismului.
Acizii și bazele
Acid – compus chimic care pune în libertate ioni de hidrogen la introducerea sa în apă. De exemplu, prin introducerea acidului clorhidric în apă, acesta eliberează ioni de hidrogen (protoni).
Un acid poate fi:
- tare – dacă eliberează toți ionii de hidrogen; de exemplu: acidul clorhidric; sulfuric, azotic.
- slab – dacă eliberează doar câțiva atomi de hidrogen; de exemplu: acidul carbonic.
Bazele pot fi:
- tari – NaOH (hidroxid de sodiu/natriu), KOH (hidroxid de potasiu);
- slabe – guanina, adenina (componente ale acizilor nucleici).
Bazele prezintă un gust amar și sunt alunecoase la pipăit.
Amoniacul – reprezintă un produs de degradare al metabolismului proteic, care în reacție cu apa formează o bază: hidroxid de amoniu. În schimb, prin acceptarea unui proton, amoniacul formează ionul amoniu.
Pentru o soluție cu pH 7, numărul ionilor de hidrogen și hidroxil este egal. O soluție cu pH 6 are de 10 ori mai mulți ioni de hidrogen decât o soluție neutră, iar o soluție cu pH 5 prezintă de 100 de ori mai mulți ioni de hidrogen.
O soluție cu pH 8 prezintă 1/10 din numărul ionilor de hidrogen al unei soluții neutre. O soluție cu pH 9 prezintă 1/100 din numărul ionilor de hidrogen al unei soluții neutre. Invers, cu cât concentrația ionilor de hidrogen este mai mică, cu atât concentrația ionilor hidroxil este mai mare.
Valoarea pH-ului înregistrată în anumite fluide ale corpului
| Substanța | pH-ul |
|---|---|
| Suc gastric | 1,4 |
| Urină | 6,0 |
| Salivă | 6,8 |
| Lapte | 7,1 |
| Lacrimi | 7,2 |
| Sânge | 7,4 |
| Suc intestinal | 7,8 |
| Suc pancreatic | 8,0 |
2.3. Compuși organici
Sunt macromolecule importante ale organismelor vii:
- glucidele;
- proteinele;
- lipidele;
- acizii nucleici.
GLUCIDELE
Glucidele sunt alcătuite din carbon, hidrogen și oxigen și care sunt utilizate ca materiale structurale și ca sursă de energie pentru organismul uman. În general, raportul dintre atomii de hidrogen și oxigen din glucide este de 2:1.
Zaharidele sunt glucidele simple.
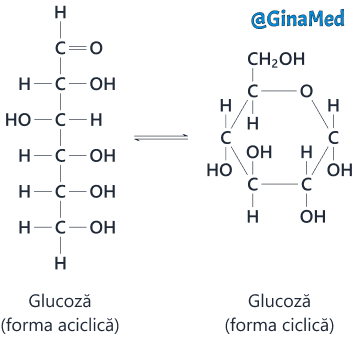
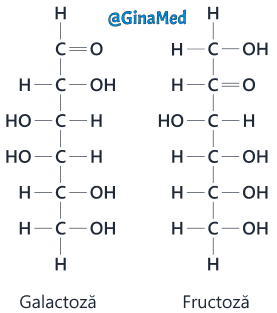
Dizaharidele reprezintă o clasă de zaharuri compuse din două unități moleculare monozaharidice legate covalent una de cealaltă.
Dizaharidele importante din organism, sunt:
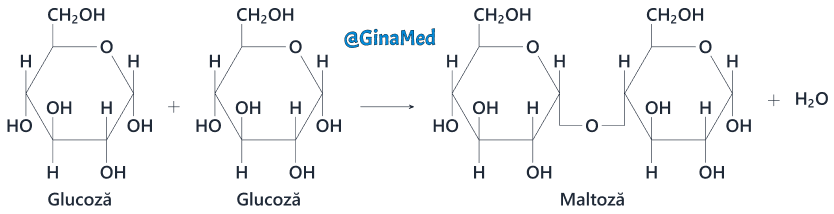
- maltoza – două unități glucidice rezultate din degradarea intestinală a amidonului;
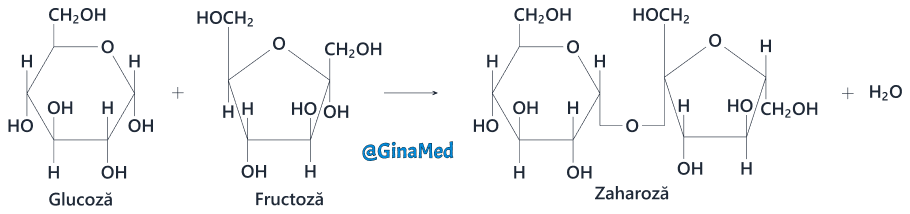
- zaharoza – sau zahărul de masă, rezultată prin unirea glucozei cu fructoza; reprezintă o sursă de energie;
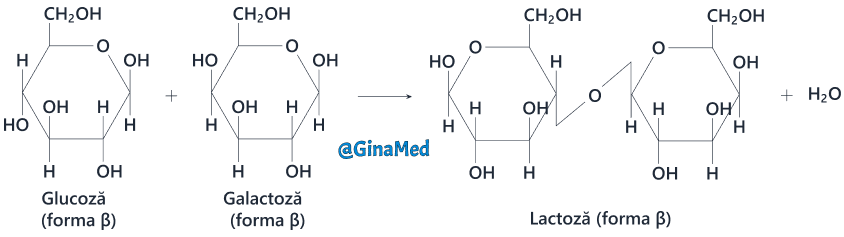
- lactoza – în alcătuirea ei intră o moleculă de glucoză și una de galactoză; reprezintă o sursă de energie și principala zaharidă din lapte.
Polizaharidele reprezintă glucidele compuse din variate combinații de monozaharide.
Amidonul, un polizaharid important format din mii de unități glucidice. Acesta reprezintă forma de depozit a glucozei la plante. La nivel mondial, o mare parte din populație își satisface nevoile energetice cu glucoza din amidonul întâlnit în variate plante: orez, grâu, porumb, cartofi.
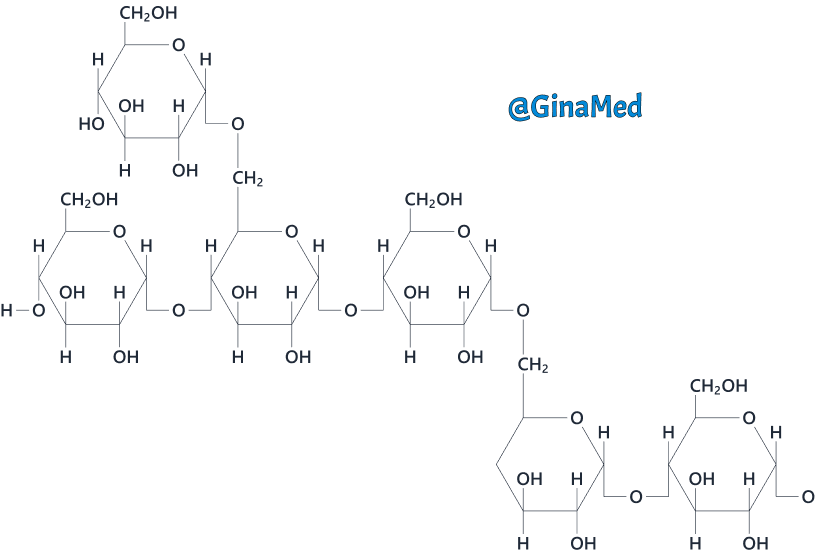
Glicogenul, un alt polizaharid important format din mii de unități glucidice, dar legate într-un mod diferit de amidon. Glicogenul constituie cea mai importantă formă de depozitare a glucozei la nivelul ficatului uman și a mușchilor scheletici (scheletului).
Celuloza, un alt polizaharid alcătuit din unități glucidice legate prin legături covalente. Acestea pot fi rupte doar de anumite specii de microorganisme. Celuloza se întâlnește la nivelul pereților celulari ai plantelor și oferă fibrele alimentare din organism.
LIPIDELE
Lipidele sunt molecule organice alcătuite din atomi de carbon, hidrogen și oxigen. În acest caz, raportul dintre atomii de hidrogen și oxigen din lipide este mult mai mare decât la glucide. Întotdeauna, porțiunea de oxigen din lipide este mai mică decât cea din glucide.
Sunt lipide:
- steroizii – structura cu 4 inele care conferă stabilitate membranară și se află la baza structurilor unor hormoni (funcții majore); exemple de steroizi: colesterol, testosteron, estrogeni;
- cerurile – de exemplu, cerumen, cutină, suberină, ceară de albine; sunt alcătuite din acizi grași și alcooli cu lanțuri lungi; conferă impermeabilitate și protecție împotriva variatelor elemente (funcții majore);
- grăsimile – sunt alcătuite din acizi grași și glicerol; depozitează de energie, izolează termic, amortizează șocuri (funcții majore); exemple: grăsime, ulei;
- fosfolipidele – sunt alcătuite din acizi grași, glicerol și fosfați și o grupă R (sau o porțiune variabilă a moleculei); intră în structura membranei celulare (funcție majoră); exemple: membrană citoplasmatică.
Grăsimile sunt compuse din:
- o moleculă de glicerol;
- una, două sau 3 molecule de acid gras – pot fi de același fel sau diferiți;
În funcție de numărul de molecule de acid gras, se obțin, mono-, di- sau trigliceride.
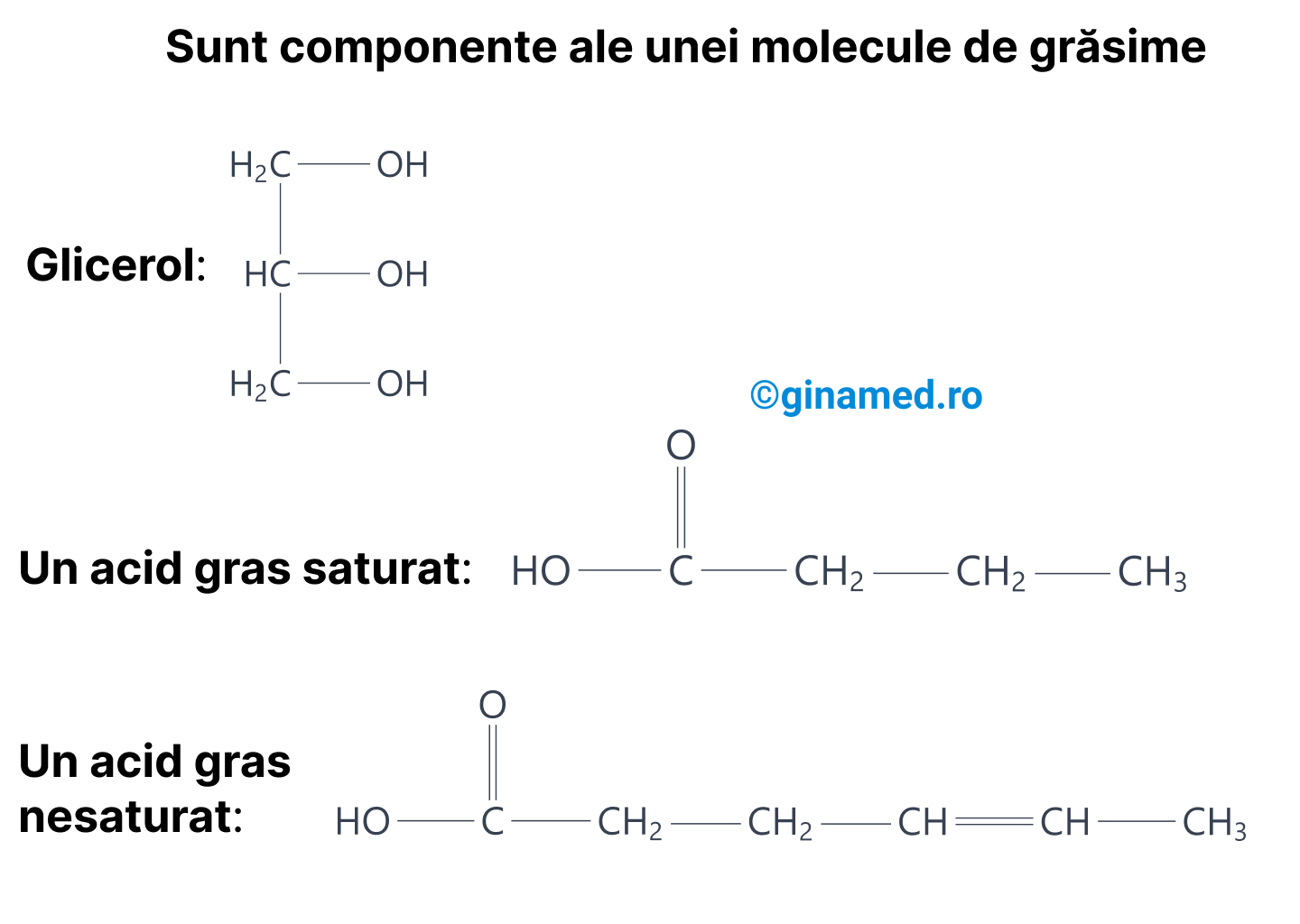
Un acid gras este format dintr-o catenă lungă de atomi de carbon (între 4 și 24), cu atomi de hidrogen asociați și o grupare de acid organic (-COOH). Legarea acizilor grași de glicerol se face printr-o reacție de eliminare de apă (deshidratare), în cursul formării legăturii covalente.
Acizii grași nesaturați prezintă una sau mai multe legături duble în moleculă. La nivelul acestora se pot lega mai mulți atomi de hidrogen. (Completare: Corect ar fi mai puțini atomi de hidrogen, dar rețineți cum este în carte pentru admitere.)
În funcție de numărul de legături duble, acizii grași nesaturați se împart în:
- acid gras mononesaturat – o singură legătură dublă;
- acid gras polinesaturat – două sau mai multe legături duble.
Acizii grași saturați nu prezintă legături duble în moleculă.
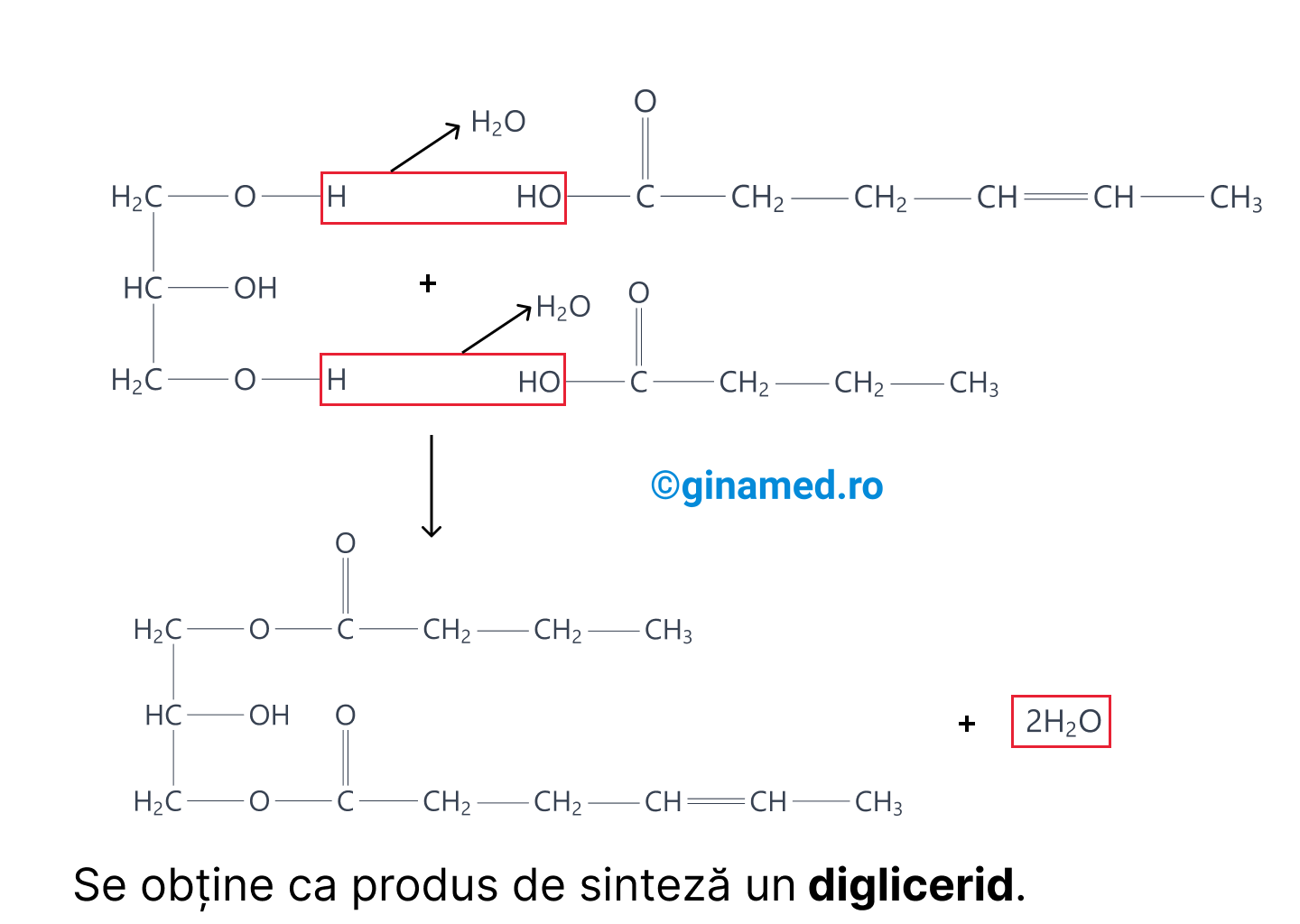
În cazul anumitor afecțiuni este de preferat să se includă în dietă acizi grași nesaturați, față de cei saturați.
Depozitarea grăsimilor la nivel celular le menține, în general, sub formă de picături clare. Țesutul adipos este cel care depozitează grăsimile intracelular, atât la animale, cât și la om. Grăsimile de la acest nivel înmagazinează o cantitate mare de energie și sunt necesare organismului. În cursul digestiei, sunt acțiunea enzimei lipază are loc degradarea grăsimilor până la stadiu de acizi grași și glicerol.
PROTEINELE
Proteinele (prezintă complexitate și mărime considerabilă) sunt alcătuite din unități de aminoacizi. În alcătuirea aminoacizilor intră carbon, hidrogen, oxigen și azot și uneori se întâlnesc și atomi de sulf sau fosfor.
Sunt 20 de tipuri variate de aminoacizi formate din:
- o grupare amino (-NH2);
- o grupare carboxil (-COOH);
- în general, un rest radical (-R) – care face diferența între aminoacizi.
Diferențele date de aranjament, tip, număr de atomi din radical (-R) dau unicitate fiecărui aminoacid. Această unicitate se exprimă prin tipurile de legături și gradul de aciditate sau alcalinitate.
Exemple de aminoacizi:
- alanina;
- valina;
- acidul glutamic;
- triptofanul;
- tirozina;
- histidina.
Formarea unei proteine are loc în urma unei reacții de deshidratare, când se pierde o moleculă de apă, rezultă din înlăturarea unui atom de hidrogen din gruparea amino a unui aminoacid și înlăturarea hidroxilului din gruparea acidă a celui de-al doilea aminoacid. Astfel, gruparea amino se leagă de gruparea carboxil și legătura covalentă astfel formată între aminoacizi se numește legătură peptidică.
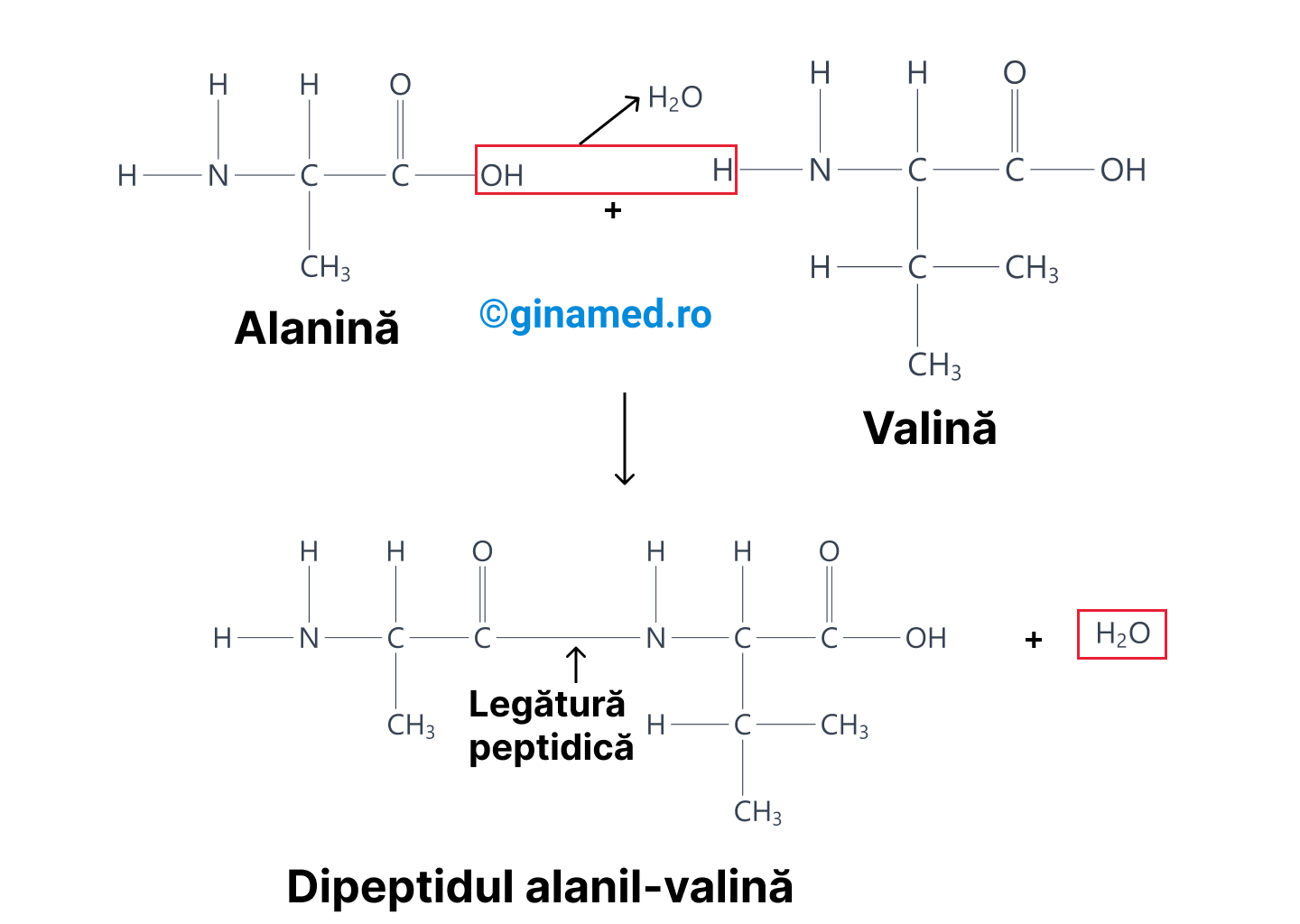
În general, denumirea folosită pentru proteinele mici este de peptide.
Necesarul proteic al corpului uman este pentru a sintetiza:
- componente celulare – de exemplu proteine musculare;
- hormoni;
- enzime.
Funcțiile majore ale proteinelor, sunt:
- catalizatori ai reacțiilor metabolice;
- hormoni;
- asigură transportul oxigenului;
- au rol structural.
Hormonii sunt responsabili de reglarea chimică a organismului. Exemple: insulina, hormonul de creștere (STH).
Enzimele sunt proteine care au rolul de cataliza cea mai mare parte a reacțiilor chimice desfășurate în celule. În cadrul unei reacții, enzimele nu sunt consumate ci pot fi folosite (rămân disponibile) pentru reacții viitoare. În absența enzimelor, chimia celulară nu s-ar putea desfășura. Acest lucru este justificat de faptul că enzimele pun la dispoziție locul în care substanțele chimice pot interacționa în cursul unei reacții chimice. În acest fel, desfășurarea reacțiilor de sinteză și de descompunere depinde mult de enzime.
Proteinele sunt întâlnite și în afara celulelor, unde funcționează ca material de suport și întărire. Totodată, proteine în cantitatea mare se întâlnesc și în oase, cartilaj, tendoane, ligamente. Proteinele intră și în alcătuirea unor hormoni: insulină, hormon de creștere; dar și în alcătuirea hemoglobinei (deci proteinele au rol în transportul oxigenului), cheratinei, colagenului.
Sinteza de proteine unice este făcută de variate celule ale corpului care adăpostesc la nivelul nucleului lor informații sub forma codului genetic din ADN care determină secvența de aminoacizi care apar în proteina finală. Cromozomii celulei au în alcătuirea lor acest cod genetic în unități funcționale, denumite gene.
Totodată, aminoacizii din structura proteinelor pot funcționa și ca sursă de energie pentru celulă. La nevoie, ficatul îndepărtează gruparea amino din aminoacid și compusul astfel rezultat este utilizat de organism pentru energie.
ACIZII NUCLEICI
Acizii nucleici reprezintă molecule foarte mari (asemenea proteinelor), formate din multiple subunități.
Funcțiile majore ale acizilor nucleici, sunt:
- ereditate;
- informații pentru sinteza proteică.
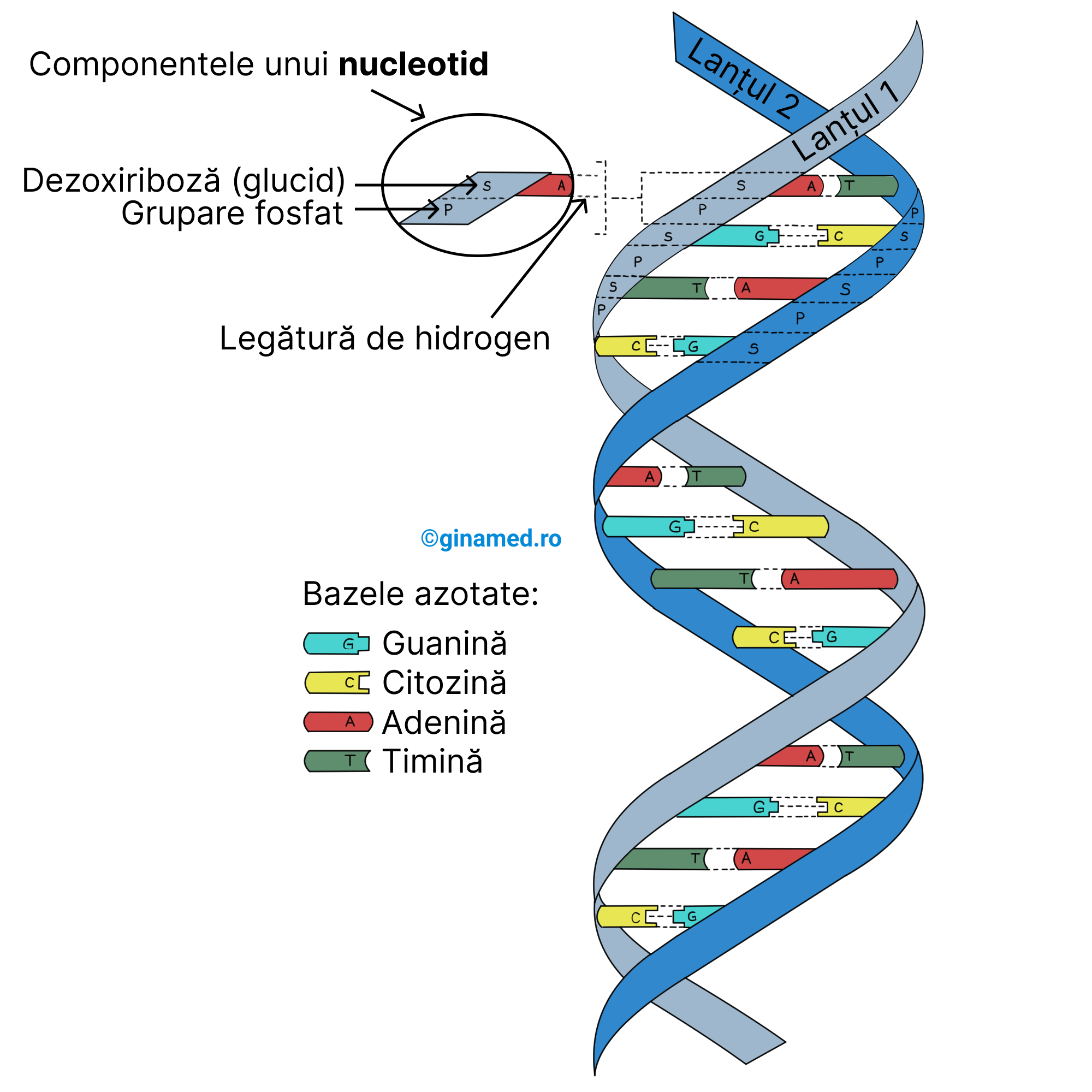
Nucleotidul reprezintă unitatea acizilor nucleici, în alcătuirea căruia intră o moleculă glucidică legată de o grupare fosfat și de azotul dintr-o moleculă, denumită bază azotată. Numele acesteia din urmă i se atribuie proprietăților sale bazice.
Cele două tipuri importante de acizi nucleici întâlniți în celulele organismului uman, sunt:
- ADN – acid dezoxiribonucleic;
- ARN – acid ribonucleic.
Comparație între ADN și ARN (componentele lor diferă ușor):
| ADN – acid dezoxiribonucleic | ARN – acid ribonucleic |
|---|---|
| se găsește în nucleul celulei (în cei 46 de cromozomi); reprezintă materialul din care sunt formate genele | se găsește în nucleol, nucleu și citoplasma celulelor; alături de ADN, participă la sinteza proteică |
| întotdeauna este asociat cromozomilor (gene) | se întâlnește în special în ribozomi și în citoplasmă sub formă de ARN mesager sau ARN de transport |
| conține un glucid cu 5 atomi de carbon (pentoză), denumită dezoxiriboză | conține un glucid cu 5 atomi de carbon (pentoză), denumită riboză |
| conține grupări fosfat care leagă zaharurile între ele în lanțul nucleotidic, cu scopul de a forma scheletul lanțului | conține grupări fosfat care leagă zaharurile între ele în lanțul nucleotidic, cu scopul de a forma scheletul lanțului |
| conține bazele purinice: adenină, guanină | conține bazele purinice: adenină, guanină |
| conține bazele pirimidinice: citozină, timină | conține bazele pirimidinice: citozină, uracil |
| funcții de sinteză proteică și de transmitere a informației genetice | funcții de sinteză proteică |
1953 – biochimiștii James D. Watson și Francis H. Crick – au propus un model universal Watson-Crick acceptat pentru structura ADN-ului: două lanțuri lungi de nucleotide cu bazele orientate spre interior, precum treptele unei scări. Guanina și citozina, precum și adenina și timina sunt complementare. Prin împerecherea guaninei și citozinei se formează o treaptă. Modul de aranjare reprezintă principiul complementarității bazelor. Cele două lanțuri de nucleotide se împletesc cu scopul de a forma un dublu helix, la cel ca o scară în spirală. Bazele lanțurilor nucleotidice sunt menținute împreună prin legături slabe de hidrogen (Completare: pe imagine se observă cum între guanină și citozină sunt 3 legături de hidrogen, iar între adenină și timină sunt două legături de hidrogen).
Secvența de baze din structura ADN-ului dictează ordinea corectă a aminoacizilor din structura proteinelor ce vor fi sintetizate. Succesiunea bazelor ADN constituie esența codului genetic.
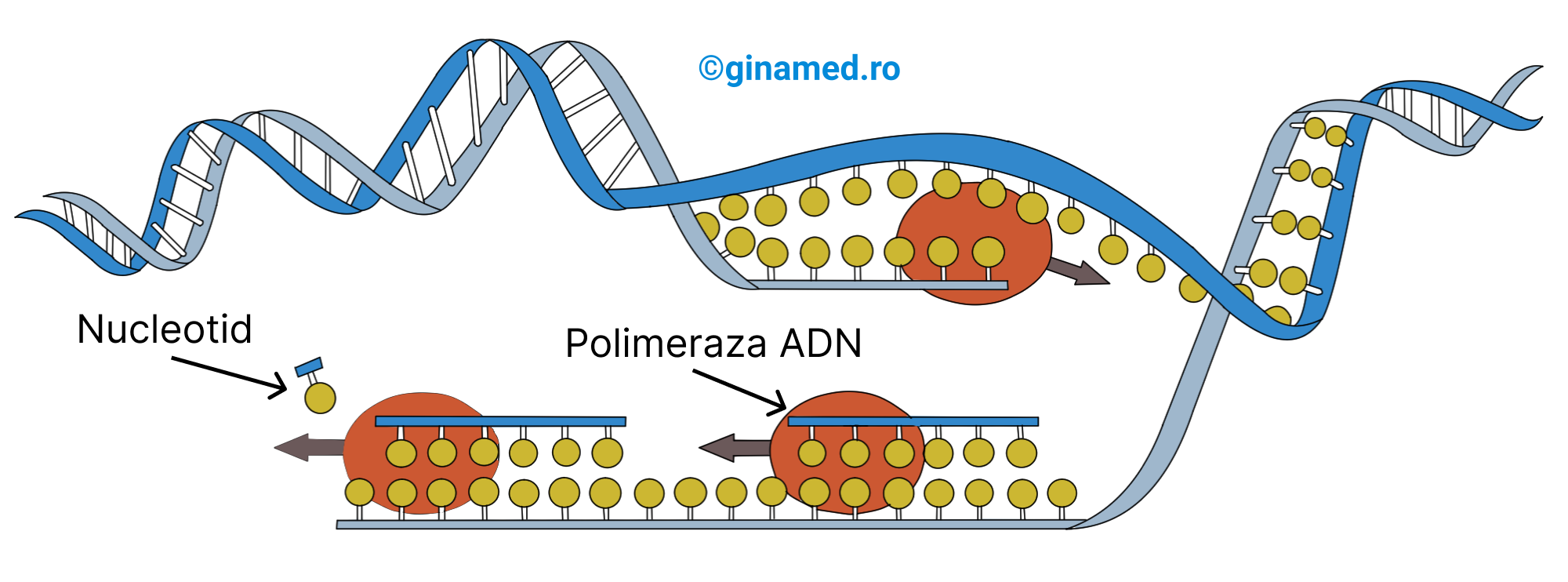
Replicarea ADN-ului precede diviziunea celulară (are loc în interfază). În celulele umane are loc replicarea a 46 de cromozomi sau 46 de molecule de ADN, după care cromozomii replicați se separă și câte 46 vor trece în fiecare nouă celulă.
Procesul de replicare al ADN-ului este inițiat de momentul în care enzimele specializate rup sau desfac dublul helix. Concomitent cu separarea celor două catene, bazele purinice și pirimidinice de pe fiecare catenă sunt expuse și în felul acesta atrag nucleotidele lor complementare, făcându-le să stea în opoziție. Enzima ADN polimerază unește componentele nucleotidice pentru a forma un șir lung de nucleotide. Astfel, fiecare catenă de ADN determină sinteza unei noi catene de ADN prin împachetarea bazelor complementare. Vechea catenă se unește cu noua catenă și rezultă un dublu helix. Procesul poartă numele de replicare semiconservativă deoarece câte o catenă veche se conservă în fiecare nou dublu helix de ADN.
ATP – adenozintrifosfatul – își are originea într-o nucleotidă din ARN, care are atașate grupări fosfat adiționale.
ATP-ul are următoarele funcții:
- acționează ca sursă de energie pentru organism;
- obținerea sa se face utilizând energia din moleculele alimentare prin procesul de respirație celulară;
- alimentează funcționarea organismului prin eliberarea unei grupări fosfat.
Bibliografie:
- Anatomie și fiziologie umană pentru admiterea la facultățile de medicină; Autori: Krumhardt B., Alcamo I.E.; Barron's & Universitatea de Medicină și Farmacie Târgu Mureș, 2022

