19. Metabolism și nutriție
Cuprins:
19.1. Introducere19.2. Adenozin-trifosfatul (ATP)
19.3. Metabolismul glucidelor
19.4. Metabolismul lipidelor
19.5. Metabolismul proteinelor
19.6. Stări metabolice
19.7. Alte aspecte ale metabolismului
19.1. Introducere
Toate procesele de natură fizică și chimică care se desfășoară în celulă constituie metabolismul. Acesta prezintă două căi (părți componente), mediate de enzime:
- anabolism – reacții de sinteză de molecule mari, complexe, pentru care, de obicei, este nevoie de energie; rezultă molecule mari; anabolismul este mediat de enzime.
Sunt procese anabolice: sinteza de glicogen, trigliceride, proteine.
- catabolism – reacții în care are loc degradarea moleculelor mari, complexe, din care rezultă molecule mici. Procesul va produce energie stocată sub formă de ATP (adenozin-trifosfat), compus cu nivel energetic crescut. Catabolismul este mediat de enzime.
Sunt procese catabolice: glicoliza, ciclul Krebs, transport de electroni.
Reacțiile catabolice converg către căi metabolice principale, pe când cele anabolice, diverg de la ele.
Calea metabolică reprezintă o succesiune de reacții chimice de descompunere a substraturilor din care rezultă produși finali. Dependent de activitatea enzimatică, reacțiile metabolice au loc, de obicei, de-a lungul unei căi metabolice. Numeroase reacții pot fi de:
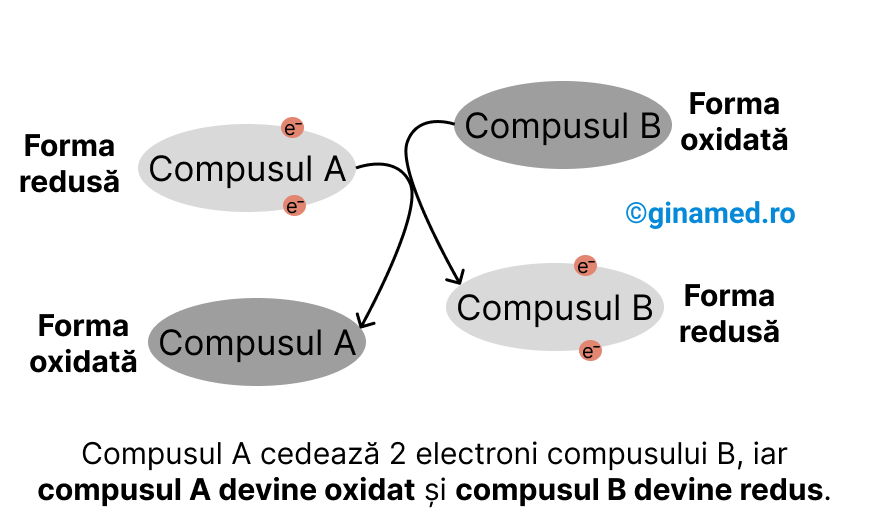
- oxidare – reacție în care substratul cedează electroni și se transformă în compus oxidat; în urma acestei reacții se poate elimina și un atom de hidrogen;
- reducere – reacție în care substratul acceptă electroni și se transformă în compus redus; în urma acestei reacții se poate accepta și un atom de hidrogen;
Deoarece electronii nu pot exista în stare liberă, ori de câte ori are loc o reacție de oxidare, aceasta va fi urmată de una de reducere.
Biochimia metabolismului este centrată pe sinteza și degradarea glucidelor (carbohidraților), lipidelor (grăsimilor), proteinelor și acizilor nucleici.
19.2. Adenozin-trifosfatul (ATP)
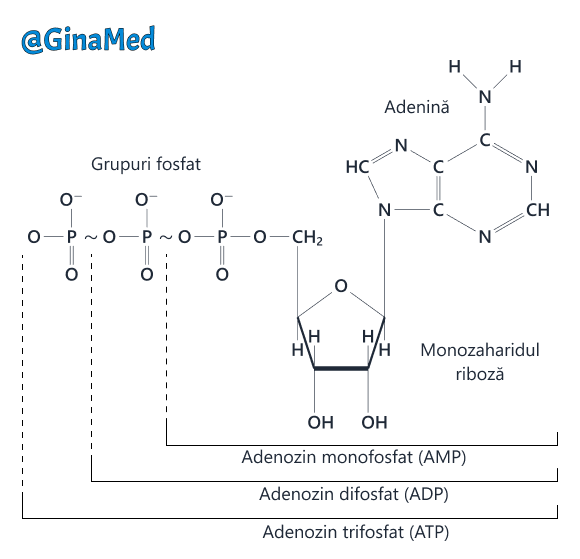
Similar reîncărcării unei baterii, ATP-ul poate fi reformat prin legarea ionului fosfat de ADP, reacție care are nevoie de energie obținută de celulă prin procesul de respirație celulară. Aceasta are un caracter complex, se desfășoară la interiorul celulei (intracelular) și implică coenzime - sunt un grup de molecule de natură organică. Coenzimele sunt porțiuni non-proteice ale enzimelor, esențiale pentru activitatea acestora.
Pentru celula umană, coenzime importante și a căror structură se apropie de cea a ATP-ului, sunt:
- NAD+ (nicotinamid-adenin-dinucleotid) – sinteza ei necesită vitamina B3 – niacină;
- FAD (flavin-adenin-dinucleotid) – porțiunea chimic activă o reprezintă grupul flavin, a cărui sinteză necesită vitamina B2 – riboflavină.
Imediat ce protonii s-au acumulat în compartimentele mitocondriale, enzima membranară ATP-sintetază favorizează întoarcerea lor în alt compartiment, punând astfel la dispoziție energia necesară formării ATP-ului prin unirea ADP-ului cu ionii fosfat. Această deplasare a protonilor poartă numele de chemiosmoză deoarece se rezumă la o mișcare a unor protoni (care sunt compuși chimici) ce traversează o membrană semipermeabilă.
19.3. Metabolismul glucidelor
Glucoza – glucidul principal disponibil ca sursă de energie în organism. Pe lângă acesta, omul mai consumă și:
- fructoză;
- galactoză;
- zaharoză;
- lactoză;
- maltoză;
- amidon.
Prin transformarea lor, rezultă glucoză sau altă moleculă înrudită, implicate în metabolismul energetic.
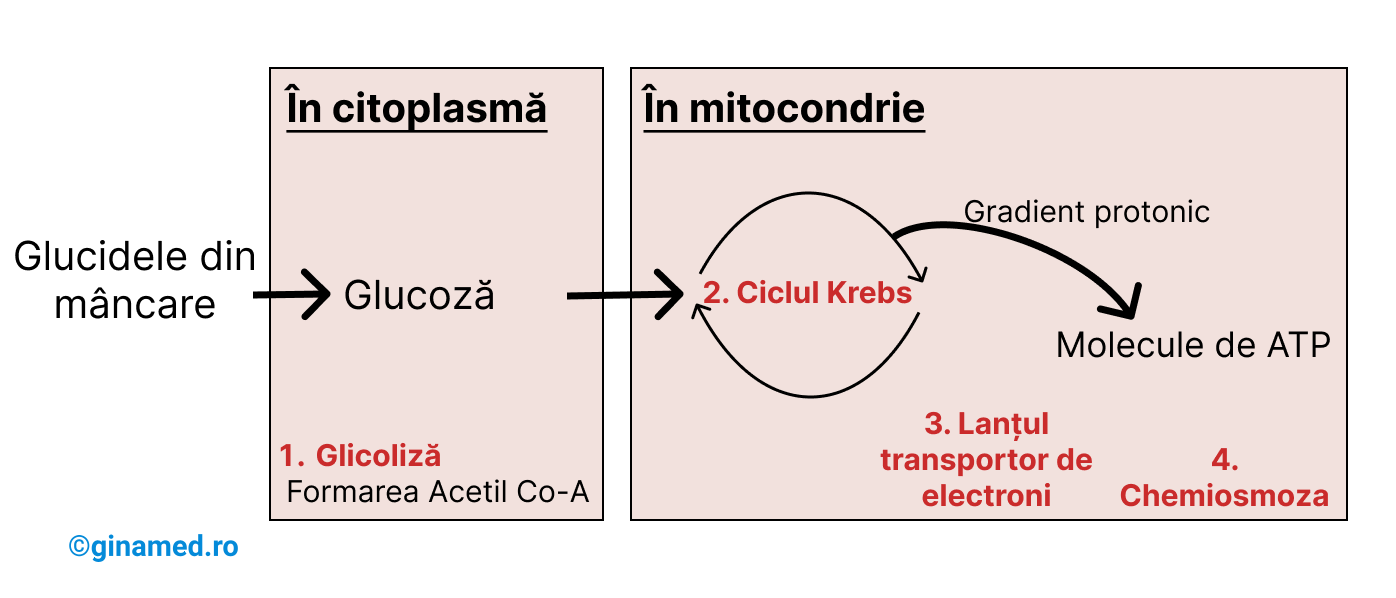
În respirația celulară, celula preia glucidele în citoplasmă și mitocondrii, pe care le descompune, eliberând energie și produși reziduali: dioxid de carbon și apă.
Respirația celulară cuprinde următoarele procese:
- glicoliză – glucoza este transformată în acid piruvic;
- ciclul Krebs (ciclul acidului citric sau ciclul acizilor tricarboxilici – CAT) – continuă degradarea acidului piruvic, iar energia rezultată este utilizată în sinteza de compuși încărcați energetic, ca de exemplu NADH;
- lanțul transportor de electroni – presupune transportul electronilor între citocromi și coenzime cu eliberare de energie;
- chemiosmoză – proces care folosește energia pentru a pompa protonii transmembranar și pentru sinteza de ATP.
Glicoliza
Glicoliza – o succesiune de reacții metabolice catalizate de cel puțin 9 enzime în urma cărora o moleculă de glucoză este metabolizată printr-o cale cu mai multe etape, pentru a produce în două molecule de acid piruvic. Această cale metabolică se desfășoară în citoplasma celulară. Glicoliza este un proces biochimic. Reactantul în procesul de glicoliză este glucoza.
Fiecare dintre etapele 1 și 3 ale căii glicolitice necesită energie pentru desfășurarea acestor reacții chimice, energie pe care o consumă din folosirea a câte unei molecule de ATP. Mai departe, molecula de glucoză este transformată într-un compus intermediar, care prin ruperea catenei de 6 atomi de carbon a glucozei vor rezulta 2 compuși cu câte 3 atomi de carbon fiecare. La rândul lor, acești compuși mai trec prin schimbări suplimentare ca la finalul procesului să se obțină două molecule de acid piruvic.
Către finalul glicolizei, se obțin 4 molecule de ATP (folosind energia eliberată în reacțiile chimice ale procesului), din care se scad cele două molecule de ATP folosite în etapele 1 și 3 și astfel câștigul net al glicolizei este de două molecule de ATP per moleculă de glucoză. Explicația pentru care se obțin 4 molecule de ATP în glicoliză reiese din reacțiile 6 și 9, care au loc fiecare de două ori, conform schemei de mai jos.
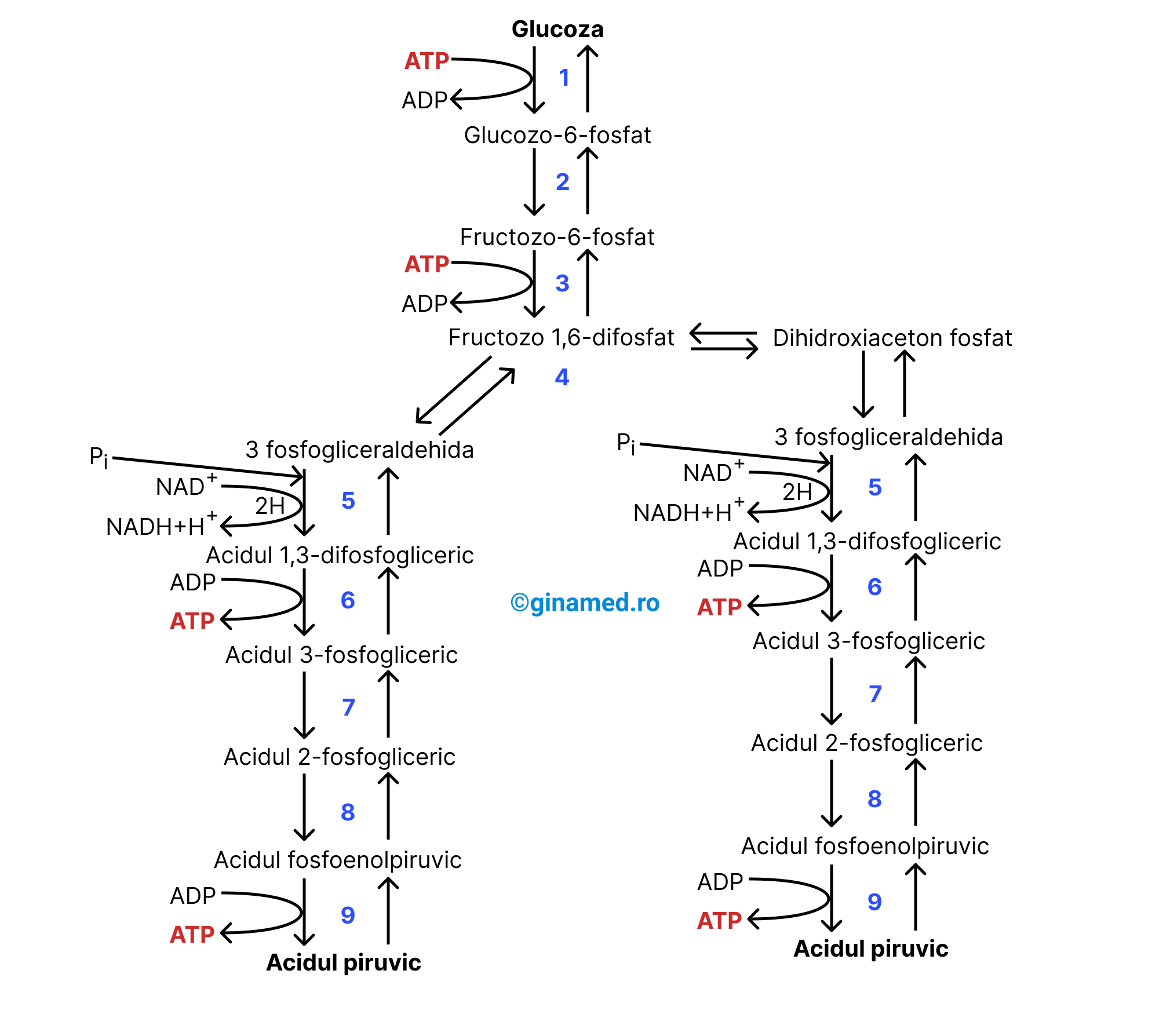
Astfel, bilanțul final al glicolizei, cuprinde următorii produși:
- două molecule de acid piruvic;
- două molecule de NADH;
- două molecule de ATP.
Ciclul Krebs
Ciclul Krebs (ciclul acidului citric sau ciclul acizilor tricarboxilici – CAT) reprezintă următorul proces care are loc după glicoliză și face parte din respirația celulară. Cele două molecule de acid piruvic rezultate în urma glicolizei, intră în ciclul Krebs, din care vor rezulta molecule cu nivel energetic ridicat de:
- NADH;
- FADH2;
- GTP.
Ciclul Krebs constituie un complex de reacții biochimice care se desfășoară în mitocondria din celulă. Produșii reziduali ai ciclului Krebs sunt două molecule de dioxid de carbon. Altfel spus, fiecărui atom de carbon intrat în ciclul Krebs îi corespunde câte o moleculă de dioxid de carbon rezultată.
Mitocondria este formată din două membrane, una externă și una internă. Aceasta din urmă prezintă anumite pliuri (criste) de-a lungul cărora se întâlnesc enzime cu importanță în pomparea protonilor și formarea ATP-ului.
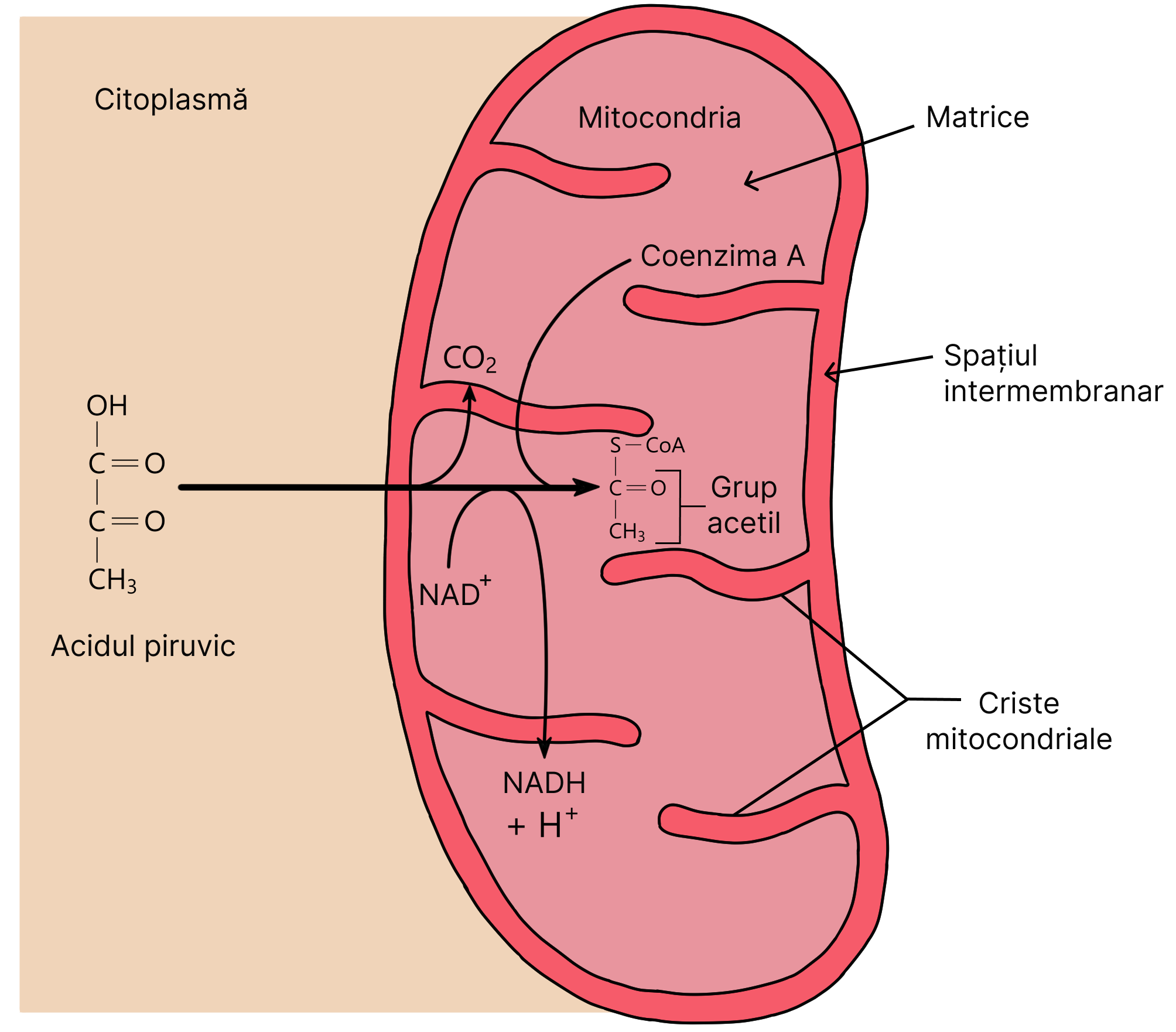
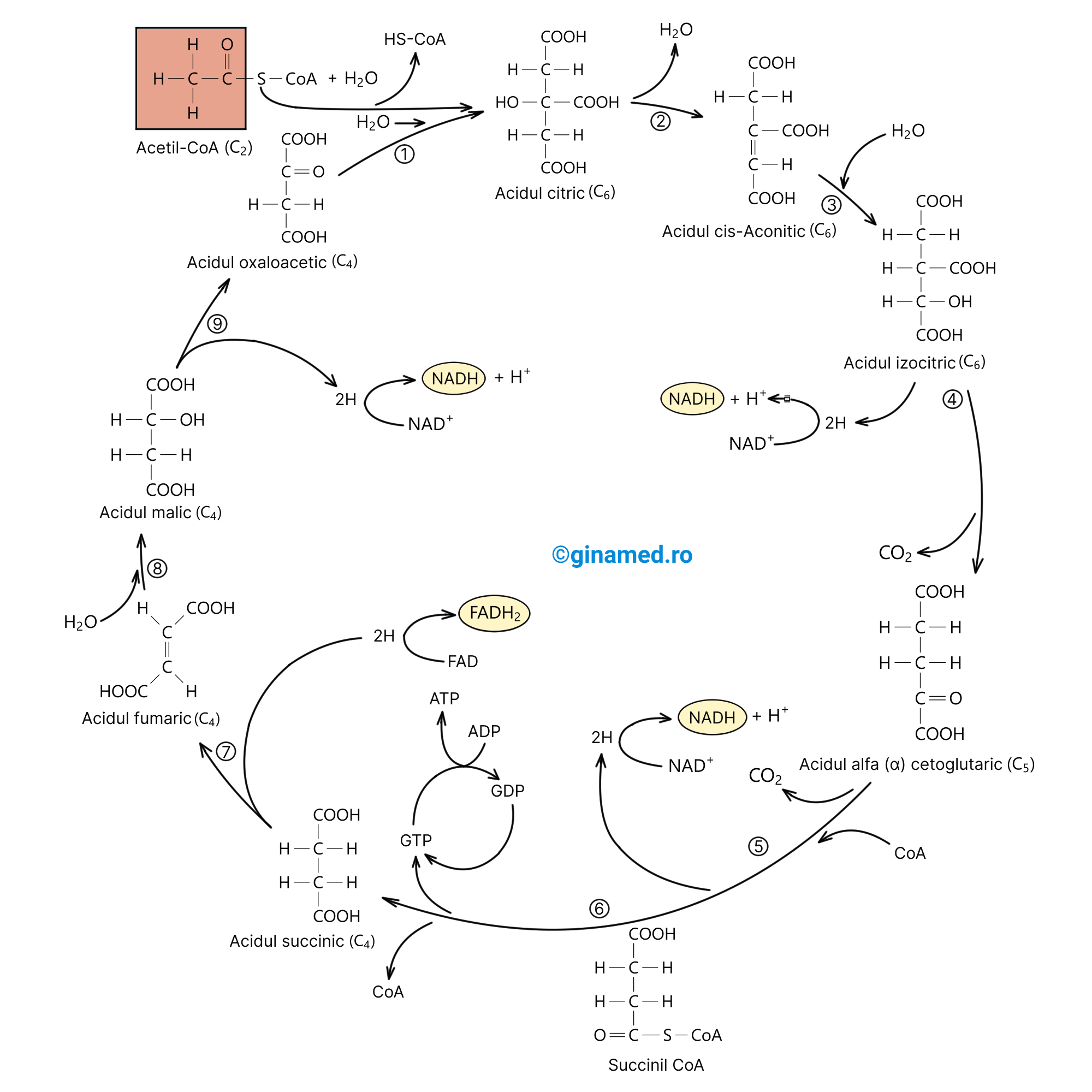
Totodată, în cursul unei reacții din ciclu (reacția 6) se pune în libertate suficientă energie încât să se sintetizeze o moleculă de ATP. Deoarece în ciclul Krebs intră inițial două molecule de acid piruvic rezultate dintr-o moleculă de glucoză, în această etapă a respirației celulare se obțin două molecule de ATP/ moleculă glucoză.
Finalul ciclului Krebs este marcat de un ultim compus chimic rezultat, și anume acidul oxaloacetic, care este identic cu cel care inițiază ciclul Krebs. Acesta este dispus să accepte o nouă moleculă de acetil-CoA pentru a relua din nou ciclul Krebs.
Astfel, bilanțul a două molecule de acid piruvic metabolizate în ciclul Krebs, cuprinde:
- două molecule de ATP;
- 6 molecule de NADH;
- două molecule FADH2;
- 4 molecule de CO2.
Lanțul transportor de electroni
Cristele mitocondriale prezintă în lungul acestora coenzime și citocromi implicați în desfășurarea lanțului transportor de electroni. În acest proces sunt implicați următorii reactanți:
- două molecule de NADH – din glicoliză;
- 6 molecule de NADH – din ciclul Krebs;
- două molecule FADH2 – din ciclul Krebs;
- 2 molecule de NADH – din procesul de formare a acetil-CoA din acid piruvic.
![Transportul electronilor. (Completare: Axa verticală ne indică nivelul energetic al electronilor, care pe măsură ce "coboară", nivelul lor energetic scade treptat. Electronii provin din NADH și [HTML]FADH<sub>2</sub>[/HTML] din glicoliză și ciclu Krebs. Energia eliberată este folosită pentru producția de ATP. NADH și [HTML]FADH<sub>2</sub>[/HTML] cedează electroni citocromilor care sunt "treptele" prin care electronii sunt transferați. La fiecare treaptă electronii pierd energie, însă aceasta este folosită pentru pomparea protonilor din matrice în spațiul intermembranar. Astfel, se creează un gradient electrochimie (o diferență de concentrație și sarcină) care face ca protonii să se întoarcă în matrice prin ATP-sintetază, favorizând sinteza de ATP. NADH intră mai sus în sistem, deci produce mai mult ATP (3 molecule), iar [HTML]FADH<sub>2</sub>[/HTML] intră de pe a doua "treaptă" și produce astfel 2 molecule de ATP. La final, electronii ajung la oxigen care împreună cu 2 protoni formează o moleculă de apă.)](/content/image-upload/transport_electroni_ginamed.png)
Oxigenul este considerat a fi acceptorul final de electroni în lanțul transportor de electroni și totodată cel care va elimina electronii din sistem. În situația în care oxigenul ar fi indisponibil în etapa finală a lanțului transportor de electroni, consecințele ar fi următoarele:
- electronii nu ar mai putea fi eliminați din citocromi și coenzime;
- citocromii și coenzimele s-ar opri din activitate;
- energia din electroni nu ar mai putea fi pusă în libertate;
- pompa de protoni ar fi nefuncțională;
- nu s-ar mai putea obține ATP.
De aici se deduce caracterul esențial al procesului respirator prin care oxigenul este introdus în corp și distribuit celulelor pentru înfăptuirea respirației celulare.
Chemiosmoza
Chemiosmoza reprezintă procesul în urma căruia rezultă efectiv moleculele de ATP în respirația celulară. Acest proces se desfășoară în cristele mitocondriale și constă în pomparea protonilor prin membrana mitocondriei în vederea stabilirii unui gradient de protoni. Atunci când gradientul este stabilit, protonii trec conform acestuia și cu ajutorul ATP-sintetazei (enzimă). Aceasta utilizează energia protonilor cu scopul de a genera ATP din substratul de ADP și ioni fosfat.
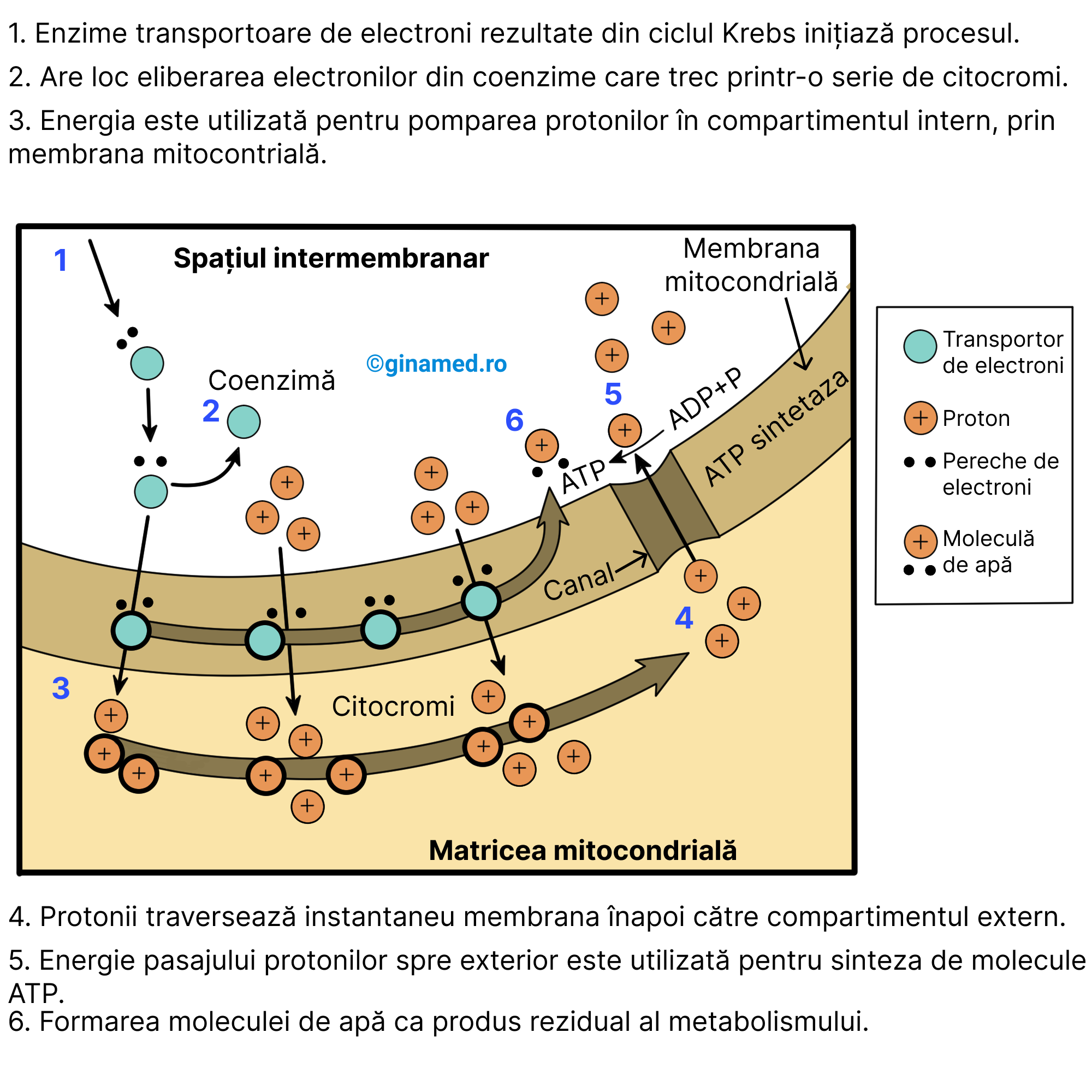
În cursul respirației celulare, prin procesul de chemiosmoză rezultă o cantitate mare (substanțială) de energie. Dintr-o moleculă de glucoză, în cursul respirației celulare rezultă un total de 34 de molecule de ATP, la care se adaugă două molecule de ATP din glicoliză și două molecule de ATP din ciclul Krebs, în final fiind 38 de molecule de ATP. Aceste molecule de ATP:
- pot fi utilizate de celulă pentru necesitățile ei energetice;
- nu pot fi depozitate pentru mult timp;
- respirația celulară trebuie să continue pentru ca moleculele de ATP să se regenereze, odată ce ele au fost utilizate.
Astfel, procesele de respirație aerobă și chemiosmoză au drept căi metabolice:
- formarea acetil-CoA (2 molecule) - proces care are loc în mitocondrie din acid piruvic (reactant) și conduce la produșii: 2 NADH, 2 molecule de CO2, acetil-CoA;
- ciclul Krebs (2 cicluri) - proces care are loc în mitocondrie din acetil-CoA (reactant) și conduce la produșii: 2 ATP, 6 NADH, 4 molecule de CO2, acetil-CoA; 2 FADH2;
- transportul electronilor - proces care are loc în membrana mitocondrială din 10 NADH și 2 FADH2 (reactanți) și conduce la produși: 34 molecule de ATP.
Fiziologia metabolismului glucozei
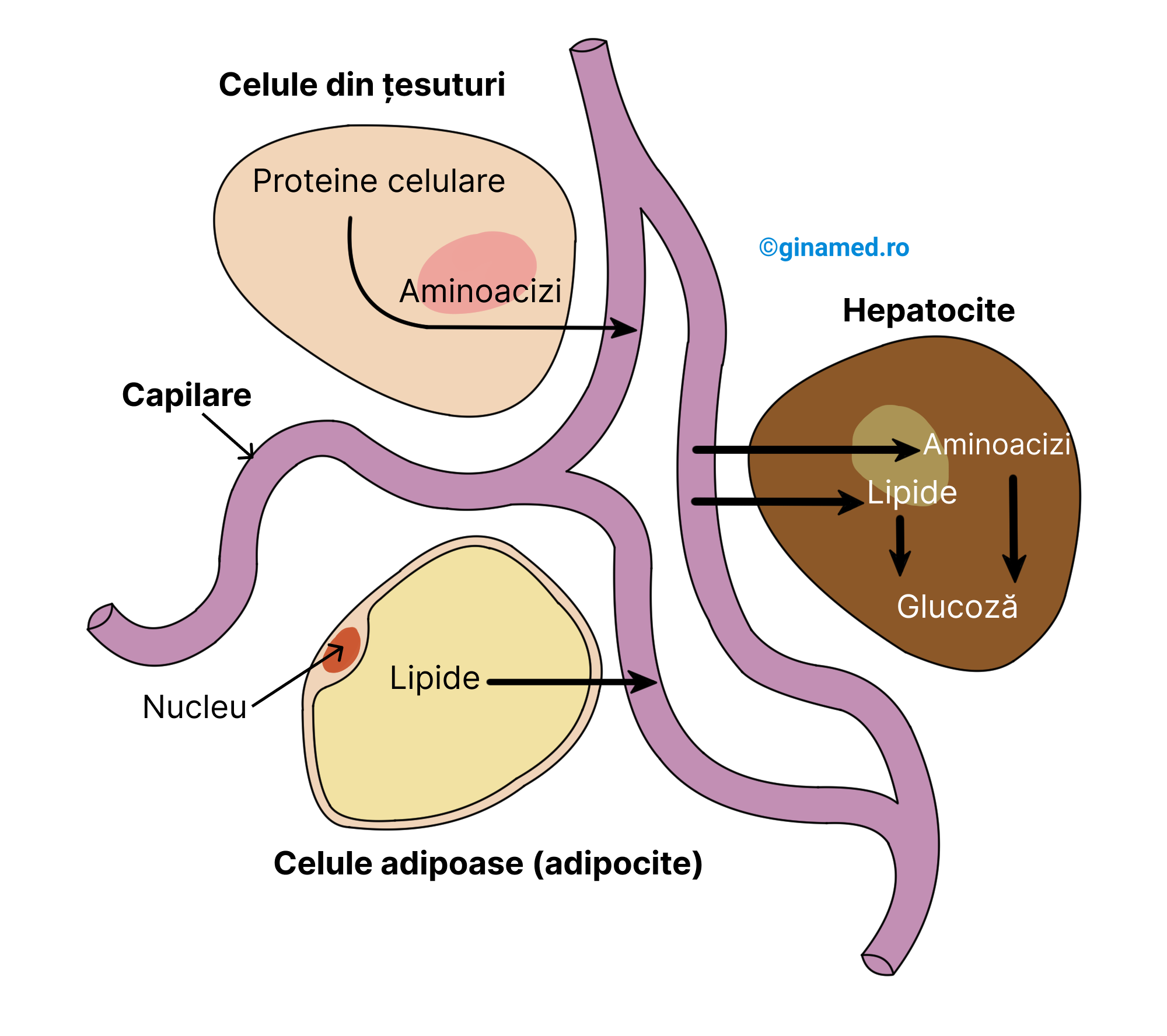
Moleculele de glucoză implicate în procesul de respirație celulară, au ajuns în fluxul sanguin în urma absorbției lor din intestinul subțire. Pe calea venei porte, glucoza alături de alte monozaharide (fructoză, galactoză) sunt transportate către ficat. La acest nivel, cele două monozaharide sunt convertite în glucoză, deoarece sub această formă monozaharidele pot fi distribuite celulelor cu scopul de a fi valorificate în respirația celulară.
Insulina, hormon secretat de pancreas, permite traversarea cu ușurință a moleculelor de glucoză prin membrana celulelor, prin creșterea afinității transportorului membranar pentru aceste molecule. În cazul în care insulina lipsește, pacientul dezvoltă diabet zaharat de tip I (insulino-dependent). Dacă celulele nu răspund la stimulul insulinic, atunci pacientul prezintă diabet zaharat de tip II.
Când concentrația de glucoză din sânge (glicemia) este crescută, ficatul depozitează moleculele de glucoză sub formă de glicogen printr-un proces denumit, glicogenogeneză.
Scăderea glicemiei eliberează glucoza în sânge prin scindarea (catabolismul) glicogenului, proces denumit glicogenoliză. Acest proces este amplificat, determinând hiperglicemie sub efectele hormonilor glucagon și adrenalină (epinefrină).
În ficat, în hepatocite se poate sintetiza glucoza din compuși neglucidici (non-carbohidrați) printr-un proces complex denumit gluconeogeneză. În acest fel glucoza obținută poate fi utilizată în metabolismul energetic. Sursele folosite pot fi: unii aminoacizi (obținuți din proteine la nivelul celulelor tisulare) care vor intra în circulația sanguină, precum și lipidele din celulele adipoase. Totodată, moleculele de glicerol și acid lactic pot fi utilizate ca surse de obținere de glucoză prin procesul de gluconeogeneză.
19.4. Metabolismul lipidelor
Produșii de digestie ai lipidelor (trigliceridelor) sunt acizii grași și glicerolul. În mucoasa intestinală, lipidele (trigliceridele), alături de proteine, colesterol și fosfolipide formează chilomicroni. Aceștia sunt picături grase de dimensiuni microscopice care pătrund mai întâi în capilarele limfatice și ulterior în circulația sanguină. De la acest nivel (din sânge), aproape toți (majoritatea) chilomicronii sunt preluați de către ficat și țesutul adipos. Lipazele (enzime) vor acționa asupra trigliceridelor, descompunându-le și punând în libertate acizi grași liberi și glicerol. Dependent de cantitatea de lipide ingerate prin dietă, o parte din aceste molecule se recombină cu scopul de a fi depozitate în țesutul adipos, iar o altă parte merge către ficat unde va suferi procese metabolice.
Numeroși acizi grași se fixează de molecule proteice de albumină din plasmă ca formă de transport către celule. Totodată, transportul moleculelor lipidice poate fi făcut și împreună cu mici cantități de proteine, când formează compuși denumiți lipoproteine, care pe baza densității lor, pot fi:
- lipoproteine cu densitatea foarte mică (very low density lipoproteins – VLDL) – conținut aproximativ de 60% trigliceride și 15% colesterol; (Completare: transportă de la ficat la celule)
- lipoproteine cu densitatea mică (low density lipoproteins – LDL) – conținut aproximativ de 50% colesterol, care depinde de aportul alimentar de colesterol și grăsimi saturate; LDL transportă colesterolul de la ficat către celule; o valoare crescută a LDL este un indice de colesterol crescut în sânge și totodată se asociază cu un risc crescut a dezvolta boli coronariene.
- lipoproteine cu densitatea mare (high density lipoproteins – HDL) – conținut aproximativ de 20% colesterol, aprox. 5% trigliceride și aprox. 50% proteine; rolul HDL este de a transporta colesterolul de la țesuturi către ficat, urmând a fi metabolizat și de a elimina din sânge trigliceridele și colesterolul; o valoare crescută a HDL se asociază cu un risc mai scăzut de instalare a unei boli coronariene, însă o valoare scăzută a HDL este dăunătoare pentru sănătate.
Catabolismul lipidelor
În celulă, lipidele (trigliceridele) sunt descompuse în glicerol și acizi grași, și valorificate mai departe ca sursă de energie prin producția de ATP (lipoliză). Mai departe, în citoplasma celulei, sub acțiunea enzimelor, glicerolul este convertit în dihidroxi-aceton-fosfat (DHAP). Acest compus reprezintă un intermediar în procesul de glicoliză, care este metabolizat în continuare până la stadiul de acid piruvic. Însă, molecula de DHAP poate urma o cale retrogradă căii glicolizei, conducând înapoi la glucoză. Astfel, glicerolul poate fi valorificat pentru sinteza de molecule de glucoză.
Comparativ cu glicerolul, metabolizarea acizilor grași se desfășoară în mitocondria celulei, în urma căreia rezultă fragmente compuse din două unități de carbon (acetil-CoA). Acest proces poartă numele de beta-oxidare. Astfel, dintr-o moleculă de acid gras cu 16 atomi de carbon, vor rezulta 8 molecule de acetil-CoA. Fiecare dintre acestea va intra în ciclul Krebs (ca și cum ar fi provenit din acidul piruvic) și va fi supusă proceselor metabolice cu eliberare de energie. Dintr-o moleculă de acid gras cu 16 atomi de carbon se obțin aproximativ 129 de molecule de ATP.
În cursul catabolismului lipidic, anumite molecule de acetil-CoA pot reacționa între ele rezultând acidul acetoacetic, care mai departe poate fi transformat în acetonă și acid beta-hidroxi-butiric. Aceste ultime două molecule sunt denumite corpi cetonici (cetone), denumire dată de prezența grupării „ceto” (-C=O) în molecula lor. În mod normal, corpii cetonici obținuți în urma catabolismului lipidic sunt în concentrație mică, deoarece conversia lor în acetil-CoA este rapidă. Însă în cazul unui catabolism lipidic accelerat (de exemplu, pacient cu diabet zaharat), crește cantitatea de corpi cetonici, instalându-se cetoacidoza. În exces, corpii cetonici cresc aciditatea corpului și pot favoriza apariția comei diabetice. O altă cauză a cetoacidozei poate fi aportul mult scăzut de glucoză în perioadele de înfometare sau un aport alimentar glucidic scăzut și lipidic crescut. Acetona din corpii cetonici determină un miros specific, asociat diluantului de lac de unghii, care se simte în respirația pacientului.
Anabolismul lipidelor
Anabolismul lipidelor constă în sinteza de lipide din molecule de acetil-CoA rezultate de obicei din molecule de glucoză. Pe această cale se asigură un mecanism prin care sunt convertite molecule de glucoză în acizi grași. În ficat, enzimele de la acest nivel pot transforma un acid gras în altul și din lipide să formeze trigliceridele. Acizii grași nesaturați care nu pot fi sintetizați de către organism și pentru care singura cale de a fi aduși în organism este prin dietă sunt acizi grași esențiali, și anume:
- acidul linolenic;
- acidul linoleic;
- acidul arahidonic.
Proveniența lipidelor în organism poate fi de natură glucidică sau proteică. Astfel, în urma unui consum crescut de glucide, glucoza este transformată în lipide prin lipogeneză. Același proces se poate aplica și unor aminoacizi, care prin intermediarii respirației celulare se pot converti în lipide.
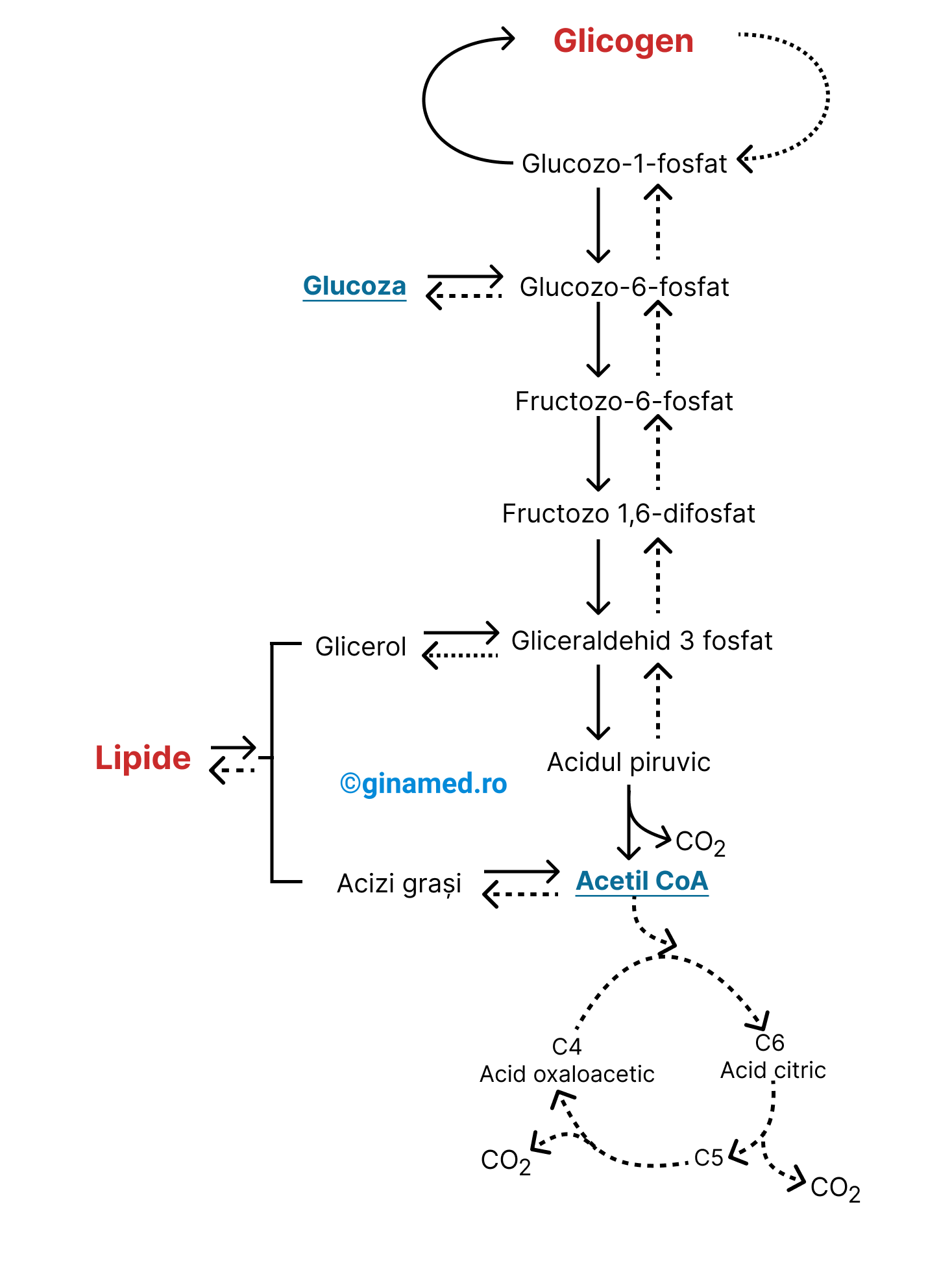
Referitor la metabolismul glucozei și lipidelor, se remarcă următoarele aspecte:
- moleculele de glucoză pot fi convertite în glicogen prin intermediarii glucozo-6-fosfat și glucozo-1-fosfat în care se transformă glucoza (marcat prin săgețile continue);
- pentru sinteza lipidelor se utilizează glicerol și acizi grași (marcat prin săgețile discontinue); ambii derivă din compuși ai glicolizei;
- pentru degradarea lipidelor (marcat prin săgeți continue) intervin alte enzime care permit desfășurarea în sens invers a reacțiilor chimice;
- din schemă se deduce că un aport crescut de glucoză determină o creștere a depozitelor de glicogen și lipide din corp.
Insulina, intervine și reglează metabolismul lipidic, inhibând enzimele implicate în degradarea lipidelor (lipaze). În cazul unul pacient cu diabet zaharat, enzimele nu mai pot fi inhibate.
Stimularea eliberării de acizi grași din țesutul adipos se face sub acțiunea următorilor hormoni:
- adrenalina (epinefrina);
- hormonul de creștere;
- glucagon;
- ACTH;
- tiroxina.
Degradarea lipidelor în țesutul adipos poate fi controlată și de sistemul nervos, astfel:
- este accelerată prin impulsuri ale sistemului nervos simpatic;
- este încetinită și duce la creșterea depunerilor lipidice sunt acțiunea stimulilor sistemului nervos parasimpatic.
19.5. Metabolismul proteinelor
Degradarea proteinelor în tractul gastrointestinal are ca rezultat aminoacizii care au intrat în alcătuirea acestora. Absorbția aminoacizilor din intestin se face activ sau prin difuziunea facilitată. Ulterior sunt transportați la ficat la nivelul căruia pot lua parte în structura unor proteine sau pot să fie eliberați în circulația sanguină cu scopul de a fi distribuiți unor celule. La nivel celular, aminoacizii sunt conectați într-o anumită secvență care semnifică codul genetic din ADN-ul celular.
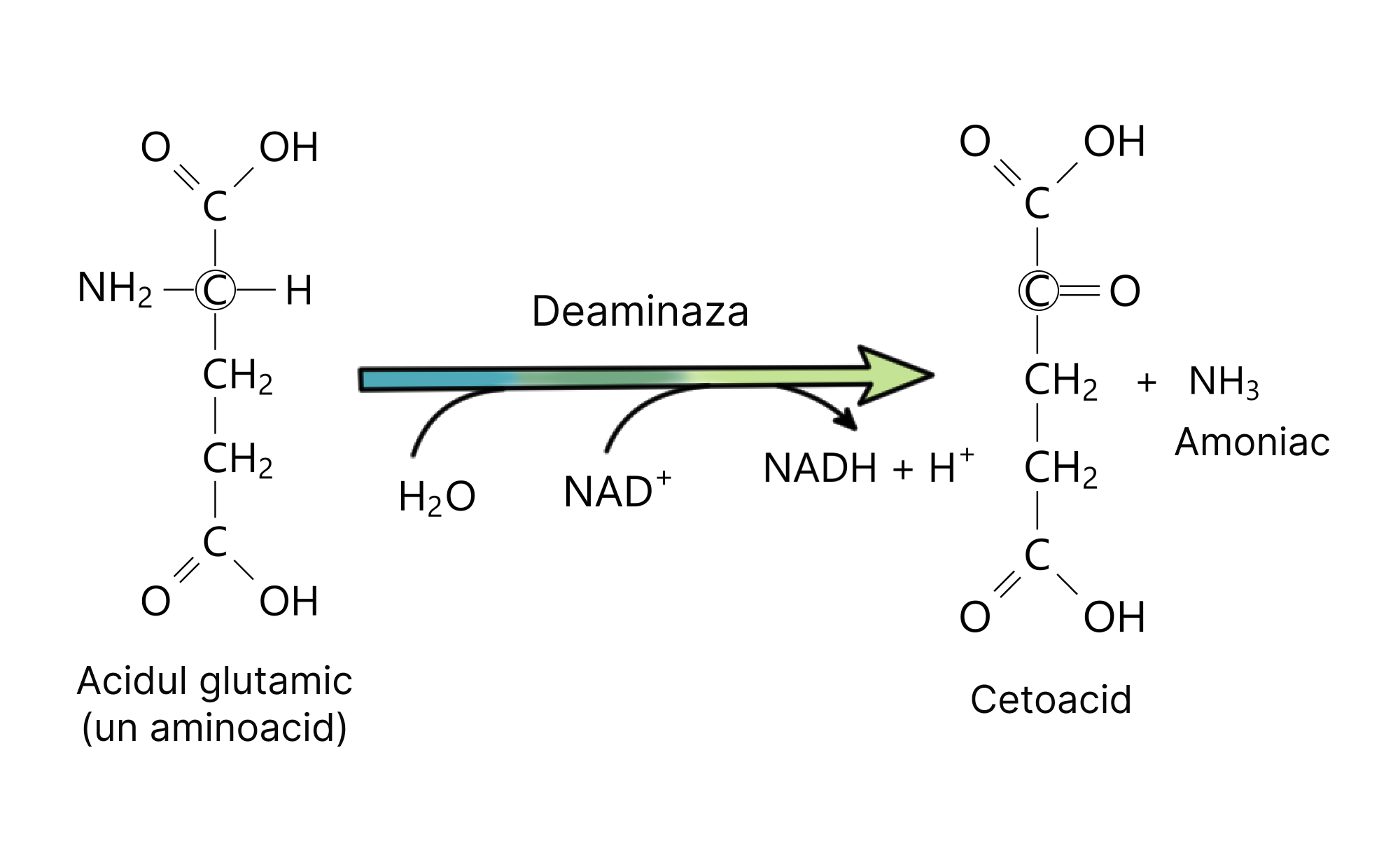
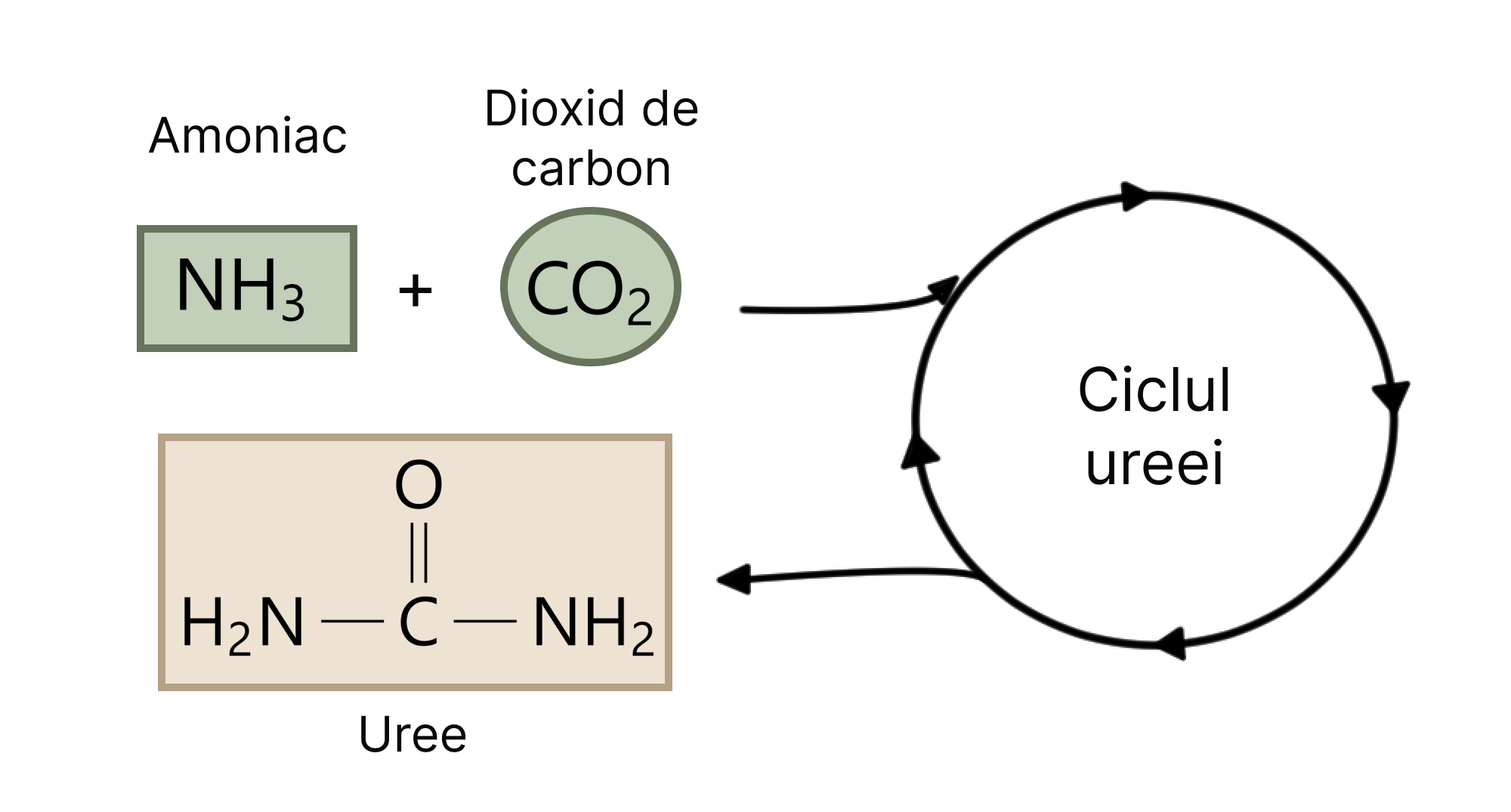
În urma reacției de dezaminare, în locul grupării amino va fi adăugat un atom de oxigen, rezultând un cetoacid. Compusul obținut se integrează în mod normal într-o secvență metabolică a procesului de glicoliză sau ciclul Krebs, care astfel poate fi valorificată în procesul respirației celulare pentru producția de energie. Sau, ar putea fi folosită pentru obținerea moleculelor de acetil-CoA, valorificate în sinteza de acizi grași (lipogeneză).
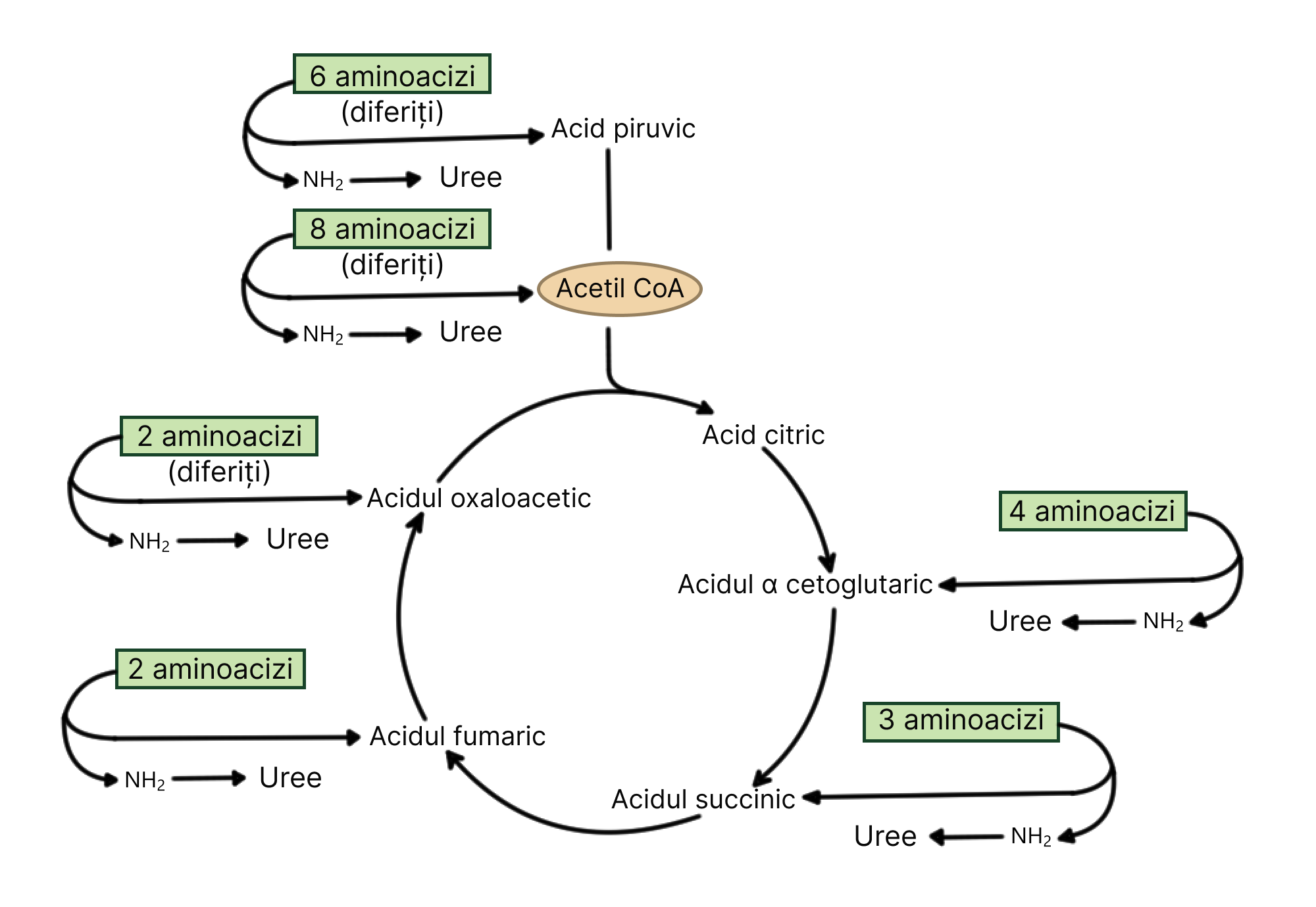
În general, după epuizarea glucidelor și lipidelor, următoarea sursă de energie vor fi proteinele.
Aminoacizii ne-esențiali reprezintă acei aminoacizi pe care organismul îi sintetizează în ficat prin transaminare (transformă un aminoacid în altul) și sunt în număr de 11.
Aminoacizii esențiali reprezintă aminoacizii care trebuie preluați din alimentație (dietă). Aceștia sunt:
- triptofan;
- valină;
- lizină;
- leucină;
- izoleucină;
- metionină;
- histidină.
Proteinele de origine animală în alcătuirea cărora intră acești aminoacizi esențiali sunt proteine complete. În cazul proteinelor de origine vegetală în schimb, de cele mai multe ori acești aminoacizi lipsesc și atunci se numesc proteine incomplete.
În reglarea metabolismului proteic, intervin următorii hormoni:
- hormonul de creștere – stimulează transportul activ al aminoacizilor în celule și folosirea lor la acest nivel în sinteza proteică;
- testosteronul (hormonul sexual masculin) și estrogenii (hormonii sexuali feminini) – stimulează sinteza proteinelor și cresc depozitele de proteine din țesuturi;
- tiroxina – crește rata metabolismului celular și influențează sinteza proteică;
- glucocorticoizii – favorizează degradarea proteică în celule.
19.6. Stări metabolice
Cele două stări metabolice în care se poate afla organismul sunt:
- starea de absorbție (postprandială) – după prânz, perioada de absorbție în sânge a substanțelor nutritive din tractul gastrointestinal;
- starea postabsorbtivă (de post) – are loc după finalizarea proceselor de absorbție, când necesitățile organismului sunt satisfăcute doar de substanțele disponibile din corp.
În cursul stării de absorbție (postprandială), organismul înregistrează următoarele evenimente:
- concentrația de glucagon din sânge scade;
- nivelul de insulină este ridicat (crește fracția insulină:glucagon) – deci, moleculele de glucoză sunt transportate către celule și utilizate ca principală sursă de energie;
- excesul de glucide este depozitat sub formă de glicogen și lipide;
- la nivel hepatic: excesul de glucide este transformat în grăsimi sau glicogen și tot ficatul este cel care pune în circulația sanguină cea mai mare parte a lipidelor cu scopul de a le transporta la țesutul adipos;
- organismul utilizează aminoacizii în sinteza proteică și aminoacizii în exces îi depozitează sub formă de lipide, în timp ce o parte din exces îl convertește în glucide;
- astfel, în sânge scad concentrațiile de glucoză, aminoacizi, acizi grași și corpi cetonici. (Completare: În Barron's este menționat că concentrația corpilor cetonici crește, dar eu consider că este o greșeală acolo. Pentru examenul de admitere învățați cum este menționat în Barron's.)
În cursul stării postabsorbtive (de post), organismul înregistrează următoarele evenimente:
- concentrația de glucagon crește;
- nivelul de insulină scade (deci, scade fracția insulină:glucagon);
- nivelul glucozei din sânge (glicemia) este menținut în homeostazie;
- are loc suplimentarea surselor de glucoză prin căi metabolice: degradarea (hidroliză) lipidică, degradarea (hidroliza) glicogenului în ficat;
- totodată are loc și hidroliza proteinelor;
- catabolismul lipidic și al aminoacizilor crește aportul de compuși energetici;
- are loc procesul de gluconeogeneză (se formează molecule noi de glucoză din aminoacizi și lipide);
- totodată, are loc și procesul de lipogeneză (generare de lipide din glucoză) (Completare: În Barron's este menționată lipogeneza în starea postabsorbtivă, dar eu consider că este o greșeală acolo. Pentru examenul de admitere învățați cum este menționat în Barron's.).
- în cazul unor perioade de post prelungit, organismul apelează la proteinele musculare (cele neesențiale pentru activitatea celulei) pe care le utilizează în scop energetic (le degradează pentru obținerea de aminoacizi care vor fi folosiți ulterior pentru sinteza de glucoză);
- astfel, în sânge cresc concentrațiile de glucoză, aminoacizi, acizi grași, corpi cetonici.
În timpul stării postabsorbtive, majoritatea țesuturilor și organelor sunt dependente din punct de vedere energetic de lipide, în primul rând. În acest fel, organismul păstrează glucoza pentru sistemul nervos a cărui sursă de energie principală este. Ficatul, pentru funcționarea sa, apelează la acizii grași, păstrând aminoacizii pentru sinteza de glucoză. Conform acestor adaptări, o persoană poate rămâne în viață chiar dacă nu consumă alimente mai multe zile, dar se hidratează corespunzător.
19.7. Alte aspecte ale metabolismului
Prin noțiunea de metabolism se înțelege și folosirea vitaminelor și a mineralelor de către organism, alături de mecanismul de reglare al temperaturii corporale.
Metabolismul mineralelor
Mineralele reprezintă un grup de câteva elemente anorganice necesare organismului (constituie circa 5% din greutatea corpului). Funcțiile acestora includ:
- reglează variate procese din organism;
- asistă activitatea anumitor enzime;
- mențin presiunea osmotică a fluidelor corpului;
- se combină des cu molecule organice (fierul în molecula de hemoglobină).
Sunt minerale:
- calciu – prezintă importanță în formarea oaselor și a dinților; reprezintă cel mai frecvent mineral din organism; prezența sa este necesară în procesul de coagulare a sângelui, precum și pentru desfășurarea normală a activităților musculară și nervoasă.
- sodiu – cel mai frecvent întâlnit cation (ion pozitiv) din fluidele extracelulare; prezintă importanță în balanță hidrică a organismului; are rol în excitabilitatea mușchilor, a nervilor și a țesutului cardiac.
- potasiu – cel mai frecvent întâlnit cation din fluidele intracelulare; prezența sa influențează transmiterea impulsurilor nervoase și contracția celulelor musculare.
- fosfor – utilizat în formarea oaselor și a dinților; intră în componența ATP și a acizilor nucleici.
- magneziu – implicat în funcționarea nervilor și a celulelor musculare; intervine în formarea osului și intră în alcătuirea a numeroase enzime.
- fier – component al mioglobinei, hemoglobinei, citocromilor (utilizați în transportul electronilor).
- iod – necesar în sinteza tiroxinei la nivelul glandei tiroide și a altor hormoni ce prezintă implicații în controlul metabolic.
- sulf – intră în structura unor aminoacizi, vitamine, citocromi.
- cupru – necesar pentru sinteza de hemoglobină și
melanină (pigment).
- zinc – esențial pentru o creștere normală; este un element component a numeroase enzime.
- mangan – reprezintă un activator enzimatic; este implicat în formarea ureei în cursul ciclului ureei.
- cobalt – face parte din structura
vitaminei B12 și intervine în procesul de maturare al eritrocitelor.
Metabolismul vitaminelor
Organismul nu are nevoie doar de glucide, lipide, proteine, minerale ci la acestea se adaugă și alți nutrienți necesari în cantități minime, denumiți vitamine. În general, modul de acțiune al acestora este similar cu al coenzimelor, fiind implicate în acest fel în mai multe procese fiziologice. Organismul nu poate sintetiza vitamine, acestea fiind obținute pe alimentară, reprezentând o componentă vitală a dietei.
Vitaminele se clasifică în:
- vitamine hidrosolubile – se absorb împreună cu apa din tractul gastrointestinal; sunt depozitate în cantități minime de către organism;
- vitamine liposolubile – se absorb împreună cu lipidele din alimente; sunt depozitate în cantități mari de către organism (mai ales vitaminele A și D, în ficat).
Vitaminele hidrosolubile și rolul acestora
| Vitamina | Rol metabolic | Alte roluri | Simptomele deficienței |
|---|---|---|---|
| Vitamina B1 (Tiamina) | coenzimă în metabolismul glucidelor | utilizată în sinteza de acetilcolină necesară funcției nervoase | boala beri-beri (tulburări digestive, slăbiciune, atrofie musculară și anumite paralizii); inapetență (lipsa poftei de mâncare), slăbiciune musculară |
| Vitamina B2 (Riboflavina) | coenzimă în metabolismul glucidic și proteic; este folosită în sinteza FAD din care face parte (coenzimă din respirația celulară și metabolismul proteic) | inflamație, descuamarea pielii | |
| Vitamina B3 (Niacina sau Nicotinamidă) | este folosită în sinteza NAD+ din care face parte (coenzimă în metabolismul energetic) | pelagră (slăbiciune musculară, diaree, tulburări mentale); fatigabilitate (stare de oboseală | |
| Vitamina B6 (Piridoxina) | coenzimă în metabolismul lipidelor și al aminoacizilor | anemie, afectare nervoasă, dermatită, tulburări gastrointestinale | |
| Vitamina B12 (Ciancobalamina) | coenzimă în formarea eritrocitelor și a acizilor nucleici; este necesară pentru maturarea eritrocitelor și pentru utilizarea unor aminoacizi | anemie pernicioasă | |
| Acid pantotenic | componentă esențială a coenzimei A, utilizată în metabolismul glucidic și lipidic; favorizează intrarea acidului piruvic în ciclul Krebs | similar altor vitamine din grupul B: slăbiciune musculară, spasme; degenerescență neuro-musculară | |
| Acid folic | coenzimă în formarea hemoglobinei și a nucleotidelor din acizii nucleici, alături de alte enzime implicate în aceste procese | intervine în formarea eritrocitelor și leucocitelor | anumite tipuri de anemie |
| Biotina | coenzimă în reacția de carboxilare (adiție/ atașare de grupări carboxil - grupări organice) din cursul sintezei de acizi grași și pentru metabolismul acizilor nucleici | rare; biotina este necesară în cantități mici | |
| Vitamina C (Acid ascorbic) | implicată în metabolismul proteic | necesară în sinteza de colagen din cursul formării țesutului conjunctiv | scorbut, alterarea formării țesutului conjunctiv, vindecarea cu întârziere a rănilor, anemie, fracturi osoase |
Vitaminele liposolubile și rolul acestora
| Vitamina | Rol fiziologic | Simptomele deficienței |
|---|---|---|
| Vitamina A (Retinol) | implicată în formarea (refacerea) pigmentului vizual rodopsină, în creșterea oaselor și a dinților și la întreținerea celulelor epiteliale | vederea în lumină slabă este alterată (nictalopie); uscarea mucoaselor |
| Vitamina D (Calciferol) | absorbția calciului și fosforului din tractul gastrointestinal; formarea oaselor și a dinților | rahitism (sinteza osoasă deficitară la copii, în special) |
| Vitamina E (Tocoferol) | implicată în formarea eritrocitelor (previne liza lor) | anemie, liza eritrocitelor |
| Vitamina K (este sintetizată de flora bacteriană normală a porțiunii terminale a tractului gastrointestinal) | organismul o folosește ca și coenzimă necesară pentru sinteza protrombinei în ficat; necesară în coagulare | tulburări de coagulare, sângerare excesivă (la nou născuți, în special) |
Rata metabolică
Cuantificarea (măsurarea) energiei consumate de organism într-un interval de timp se numește rată metabolică. În general, măsurătorile se efectuează în stare de repaus sau pe nemâncate, deoarece în aceste condiții, organismul nu stochează energia, ci doar își desfășoară activitatea internă.
Valoarea energiei consumate de către organism variază direct proporțional cu căldura produsă de acesta. Cuantificarea acesteia din urmă poate fi făcută:
- direct – măsurarea directă a căldurii produse de organism se face cu ajutorul calorimetrului, un dispozitiv compus dintr-o cameră izolată în care este plasat subiectul. Acesta va produce căldură care va încălzi aerul din cameră, măsurându-se astfel rata creșterii temperaturii.
- indirect – măsurarea indirectă a căldurii produse de organism se face prin măsurarea ratei consumului de oxigen de către organism.
Cu scopul de a fi comparate, măsurarea ratelor metabolice se alege de cele mai multe ori să se facă în condiții postabsorbtive (de post), în anumite condiții standard care să elimine cât mai multe variabile. Astfel, rata metabolismului bazal (RMB) reprezintă consumul de energie raportat la unitatea de timp și pe kg corp, măsurat în condiții bazale. Altfel spus, RMB constituie energia minimă necesară proceselor de respirație, digestie, circulație și alte stări ale organismului în stare de veghe.
Valoarea ratei metabolismului bazal este influențată de:
- hormoni – de exemplu, metabolismul celular este crescut sub influența hormonilor tiroidieni;
- dimensiunea și suprafața corporală – RMB scade când dimensiunea este mare;
- vârsta – în copilărie, RMB este crescut;
- sex – RMB a bărbaților este puțin mai crescută comparativ cu RMB a femeilor;
- temperatura corporală – creșterea temperaturii crește RMB.
După ingerarea unui prânz normal, metabolismul înregistrează o creștere cu 10-20%, accelerare metabolică denumită efect termic al alimentelor. Efectul termic al proteinelor îl depășește pe cel al glucidelor și lipidelor, motiv pentru care un prânz bogat proteic implică o procesare mai intensă a nutrienților de către organism și implicit o rată metabolică ușor crescută.
Atunci când există un echivalent între valoarea energetică a alimentelor ingerate și energia consumată de activitatea organismului, greutatea corporală se va menține constantă.
Valoarea energetică a alimentelor se cuantifică în kilocalorii (kcal)/g. 1 kcal = cantitatea de căldură necesară creșterii temperaturii unui gram de apă cu 1°C.
Reglarea temperaturii corporale
Corpul uman își produce propria cantitate de căldură și totodată își menține temperatura constantă. Măsurată dimineața, în condiții standard în cavitatea orală, temperatura normală are o valoare aproximativă de 36,7 °C (98,6 °F), dar care poate prezenta variații dependente de: activitatea subiectului, perioada din zi, locația unde se efectuează măsurătoarea.
Rezultatul producției de căldură în cursul metabolismului și al pierderii de căldură definește temperatura corporală. Pierderea de căldură către mediul înconjurător este realizată prin diferite mecanisme:
- radiația – proces prin care căldura se pierde sub forma radiațiilor infraroșii;
- evaporarea – are loc în cursul transpirației și perspirației;
- conducția – proces prin care, în urma contactului direct dintre suprafețele a două obiecte din mediul înconjurător (de exemplu, corp-aer, corp-apă), energia se transferă de la atom la atom;
- convecția – proces prin care moleculele de aer ating corpul, primesc căldura de la acesta prin conducție și apoi sunt îndepărtate și înlocuite ulterior de alte molecule care vor primi la rândul lor căldura de la suprafața corpului. Prin acest proces, sunt aduse constant molecule de aer sau de apă în contact cu corpul. Dacă intervin curenți de aer (vântul), procesul este accelerat.
Activitatea centrului termoreglator din hipotalamus intervine în mare parte în reglarea temperaturii corporale. Neuronii de la acest nivel funcționează similar unui termostat. Atunci când valoarea temperaturii corpului scade sub valoarea normală, centrul nervos hipotalamic trimite impulsuri pentru conservarea căldurii în corp. În situația opusă, impulsurile trimise au scopul de a favoriza pierderile de căldură.
Stimulii trimiși (aferenți) către centrul hipotalamic au originea în receptorii de temperatură din piele și unele mucoase, denumiți receptori termici periferici. Totodată, și hipotalamusul dispune de receptori care pot detecta modificările de temperatură ale sângelui, denumiți receptori termici centrali. Aceștia se mai întâlnesc și în: măduva spinării, organele abdominale, alte structuri interne.
Creșterea temperaturii corporale peste normal se numește febră, apărută în urma unui stres fiziologic (ca de exemplu, inflamația, reacția alergică). Astfel se eliberează substanțe pirogene care vor acționa asupra hipotalamusului setându-i valoarea termostatului pentru temperatură înaltă.
Pe de altă parte, reacțiile organismului de tipul: tremurături, vasoconstricție, frisoane sunt asociate cu încercarea organismului de a conserva temperatura pentru a atinge temperaturi înalte. În absența substanțelor pirogene (substanțe care induc răspuns febril), febra dispare, iar prin transpirație și vasodilatație se înregistrează pierderi de căldură în urma cărora temperatura corporală își recapătă valoarea normală.
Bibliografie:
- Anatomie și fiziologie umană pentru admiterea la facultățile de medicină; Autori: Krumhardt B., Alcamo I.E.; Barron's & Universitatea de Medicină și Farmacie Târgu Mureș, 2022
- Structura adenozin-trifosfatului (ATP)

