5. Alchine
Cuprins:
5.1. Definiție și serie omoloagă5.2. Denumirea alchinelor
5.3. Structura alchinelor
5.4. Izomeria alchinelor
5.5. Proprietăți fizice
5.6. Etina (acetilena)
5.7. Proprietăți chimice
5.8. Utilitatea practică a acetilenei
5.1. Definiție și serie omoloagă
Alchinele sunt hidrocarburi acicilice nesaturate care prezintă în moleculele lor o legătură triplă între 2 atomi de carbon.
5.2. Denumirea alchinelor
Alchinele se denumesc prin înlocuirea sufixului „-an” din numele alcanului, cu sufixul „-ină”.
Denumirile și formulele primelor 4 alchine:
| n | Formula moleculară | Formula de proiecție | Formula restrânsă de structură plană | Denumire |
|---|---|---|---|---|
| 1 | C2H2 | etină | ||
| 2 | C3H4 | propină | ||
| 3 | C4H6 | 1-butină | ||
| 4 | C4H6 | 2-butină |
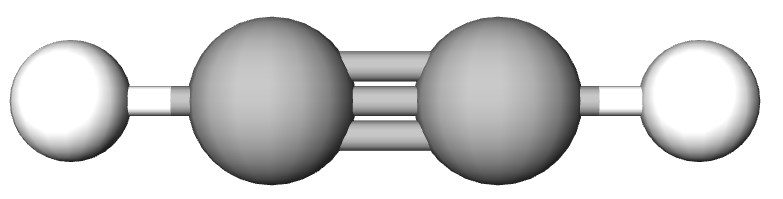
Formulele de structură pentru etină/ acetilenă:
| Formula Lewis | Formula de proiecție | Formula restrânsă de structură plană |
|---|---|---|

Începând cu al treilea termen al seriei omoloage a alchinelor, în denumirea acestora se menționează poziția triplei legături. Astfel, alchinele pot fi:
- alchine marginale – unde tripla legătură se află la capătul catenei;
- alchine interne – unde tripla legătură se află în interiorul catenei.
În ceea ce privește alchinele cu catenă ramificată, denumirea acestora se face conform unor reguli asemănătoare celor stabilite de IUPAC pentru denumirea alchenelor cu catenă ramificată și discutate anterior.
5.3. Structura alchinelor
Diferența structurală între o alchină și alcanul cu număr similar de atomi de carbon, este dată de prezența unei legături triple între 2 atomi de carbon în molecula alchinei.
În starea de valență a atomului de carbon, dacă se combină un orbital de tip s cu un orbital de tip p, se formează 2 orbitali cu aceeași geometrie și energie, care poartă numele de orbitali sp. Fiecare dintre aceștia este ocupat cu câte un electron. Orbitalii sp prezintă o geometrie coaxială (digonală).
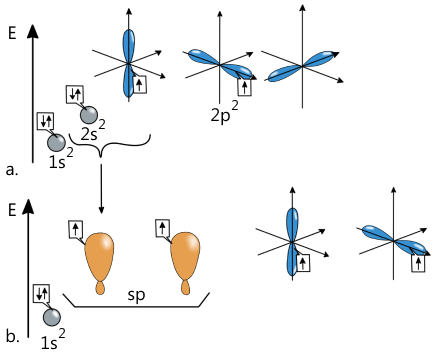
Astfel, în starea de valență atomul de carbon prezintă 2 orbitali de tip sp și 2 orbitali p, a căror formă și energie nu s-au modificat. Atomul de carbon aflat în această stare de valență se combină cu un alt atom de carbon aflat într-o stare de valență identică. Astfel, fiecare atom de carbon participă la formarea legăturii chimice stabilite între 2 atomi de carbon, cu câte un orbital sp și cu câte 2 orbitali de tip p. Prin întrepătrunderea orbitalilor de tip sp se formează o legătură de tip σ. Prin interacția ce se stabilește între orbitalii de tip p, orientați perpendicular unul pe celălalt și perpendicular pe planul în care se află legătura σ, favorizează formarea a două legături de tip π.
![a. Geometria orbitalilor sp; b. Formarea legăturii σ și a celor două legături π între 2 atomi de carbon; c. Legăturile chimice în molecula [HTML]C<sub>2</sub>H<sub>2</sub>[/HTML] (acetilenă).](/content/image-upload/geometria_orbitali_sp_chimie.png)
În acest fel, între cei 2 atomi de carbon s-a format o legătură triplă, care este alcătuită dintr-o legătură σ și două legături π.
Unghiul dintre legăturile C–H din molecula acetilenei prezintă valoarea de 180°. Deci, atomul de carbon implicat într-o legătură triplă formează două unghiuri coplanare (cu un unghi de 180° între ele) și două legături π.
Faptul că planurile în care se află cele două legături π sunt perpendiculare între ele, dar și perpendiculare pe planul legăturii σ, nu se permite rotația liberă în jurul legăturii triple.
În cazul alchinelor marginale, prezența celor două legături π fac ca legătura triplă să fie polară, având un pol pozitiv la atomul de hidrogen și un pol negativ la atomul de carbon triplu legat:
5.4. Izomeria alchinelor
Alchinele pot prezenta izomerie de constituție (de structură) astfel:
- alchinele care au în moleculă cel puțin 4 atomi de carbon, prezintă izomerie de poziție; de exemplu, alchina cu formula moleculară C4H6 prezintă 2 izomeri de poziție: 1-butina, și 2-butina, .
- alchinele care au în moleculă mai mult de 4 atomi de carbon, prezintă și izomerie de catenă; de exemplu, alchina cu formula moleculară C5H8, prezintă 2 izomeri de poziție: 1-pentină, și 2-pentină, și un izomer de catenă: 3-metil-1-butină, .
5.5. Proprietăți fizice
Starea de agregare
- în condiții obișnuite, primii termeni din seria omoloagă a alchinelor (acetilena, propina, 1-butina) sunt gaze;
- următorii termeni, începând cu 2-butina, sunt substanțe lichide;
- termenii superiori din seria omoloagă a alchinelor sunt solizi.
Puncte de topire și de fierbere
Față de alcanii și alchenele cu număr similar de atomi de carbon, alchinele înregistrează valori ale temperaturilor de topire (p.t.) și de fierbere (p.f.) puțin mai mari.
| Alchina | p.f. °C | p.t.°C |
|---|---|---|
| Etina | -84 | -82 |
| Propina | -23 | -103 |
| 1-butina | +8 | -122 |
| 2-butina | +27 | -32 |
| 1-pentina | +40 | -106 |
În seria omoloagă a alchinelor se remarcă o regularitate în creșterea valorilor proprietăților fizice în același timp cu creșterea masei molare.
Solubilitatea
Datorită caracterului polar al legăturii triple, acetilena este parțial solubilă în apă. La o temperatură de 0°C, 1 volum de apă, dizolvă 1,7 volume de acetilenă. Acetilena este solubilă și în solvenți organici. Transportul acetilenei nu se poate realiza în stare lichefiată, în tuburi sub presiune, deoarece în astfel de condiții, explodează. Pentru transportarea acesteia se utilizează tuburi de oțel umplute cu o masă poroasă îmbibată în acetonă, în care acetilena este foarte solubilă. 1 volum de acetonă poate dizolva până la 300 de volume de acetilenă la presiunea de 12 atm.
5.6. Etina (acetilena)
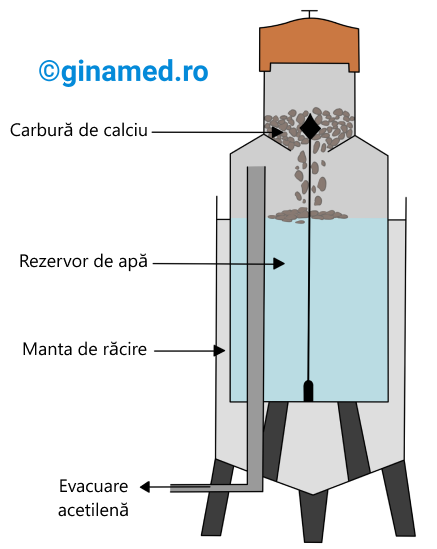
Metode de obținere
Obținerea acetilenei din carbid
În industrie, obținerea carbidului se face prin desfășurarea următoarelor reacții chimice:
ACTIVITATE EXPERIMENTALĂ
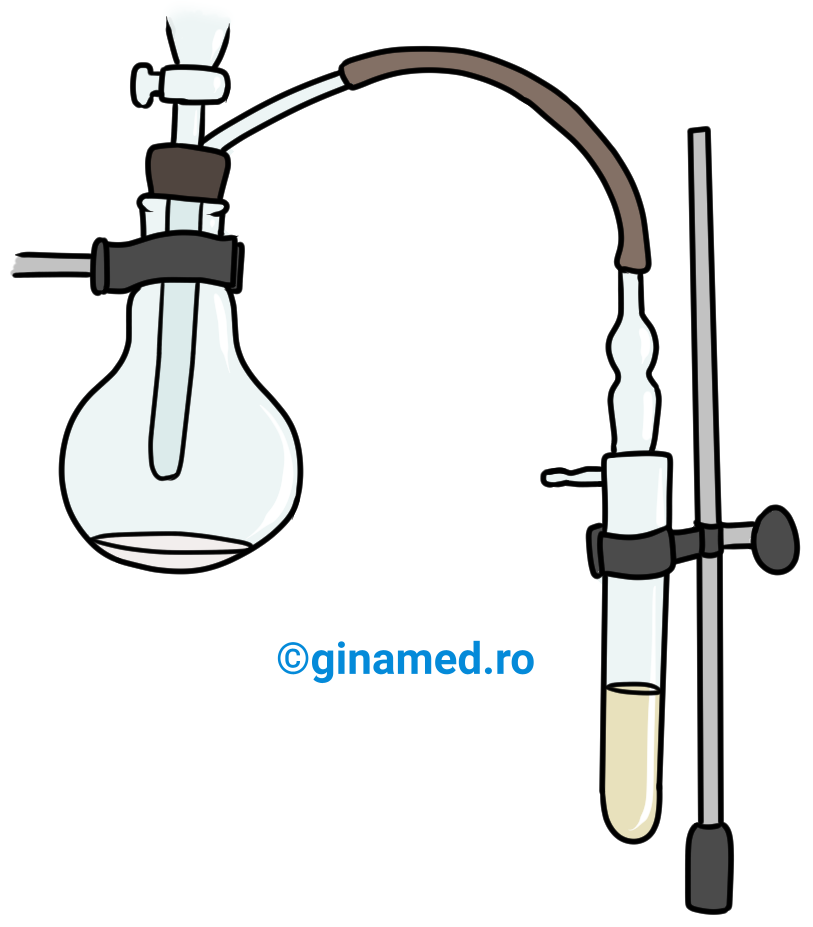
Mod de lucru: vasul de reacție alcătuit din sticlă rezistentă termic, poate fi: un pahar conic ce prezintă un tub lateral (denumit, vas de trompă) sau un balon cu fund rotund cu tub lateral în partea superioară a gâtului (un astfel de instrument se numește balon Wurtz).
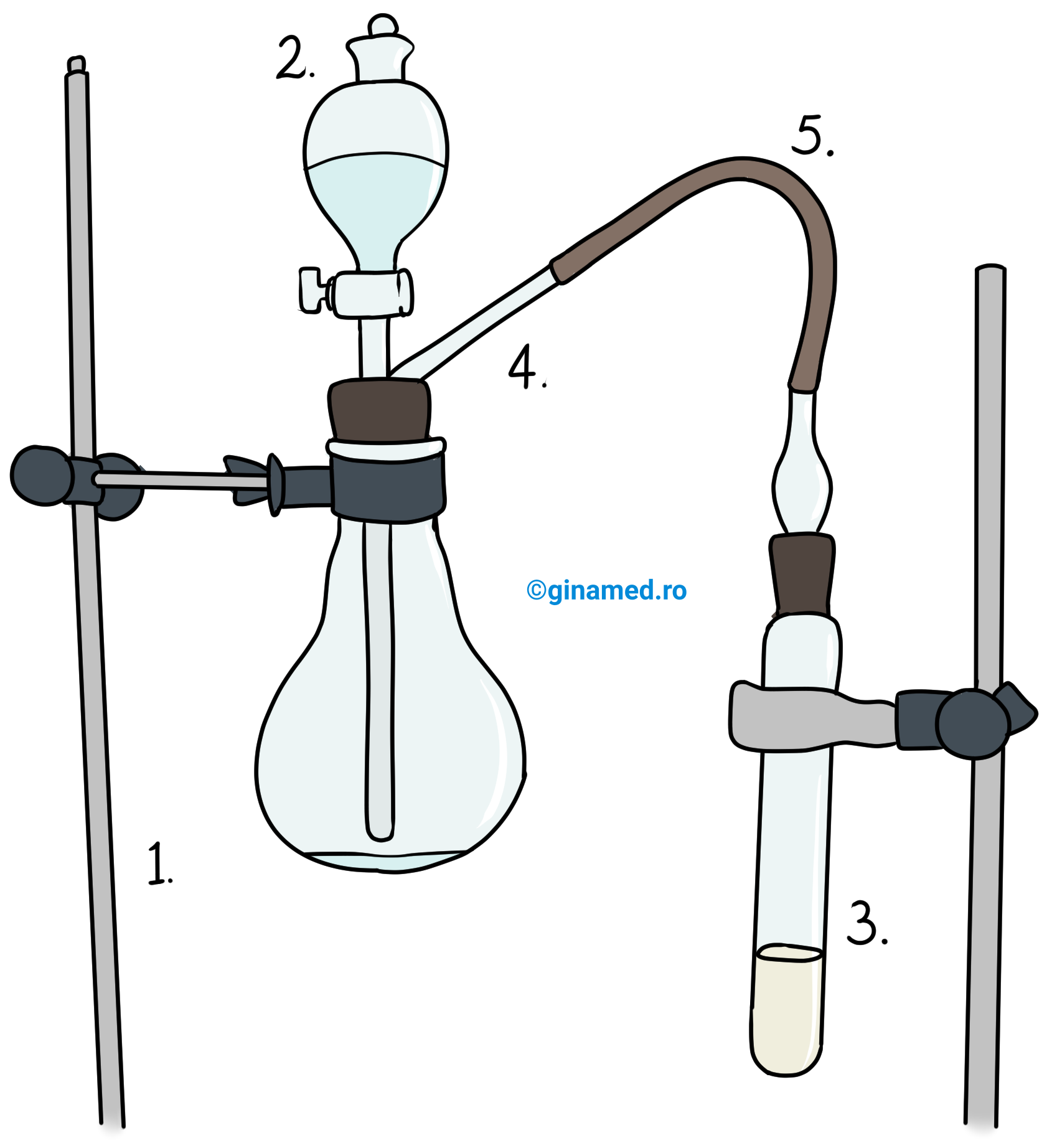
În balonul Wurtz (notat pe desen cu cifra 1) se pune carbid, peste care se aduce apă dintr-o pâlnie picurătoare cu robinet (notat pe desen cu cifra 2). Din reacție se degajă acetilena care ajunge în vasul de prindere (notat pe desen cu cifra 3), traversând tuburi de sticlă (notat pe desen cu cifra 4) și racorduri de cauciuc (notat pe desen cu cifra 5). În vasul de prindere se pune un reactiv (în acest caz se va folosi apa ca solvent) care va reacționa cu acetilena.
Observație: În vasul de reacție se desfășoară o reacție violentă din care se degajă un gaz care barbotează în soluția din vasul de prindere al instalației. Vasul în care are loc reacția se încălzește deoarece reacția este puternic exotermă.
Obținerea acetilenei din metan
5.7. Proprietăți chimice
Prezența legăturii triple în molecula acetilenei, influențează comportamentul chimic al acesteia. Faptul că legătura triplă se compune dintr-o legătură σ și două legături π, atribuie acetilenei un caracter nesaturat mai pronunțat comparativ cu cel al alchenelor.
Proprietățile chimice ale acetilenei se manifestă prin:
- reacții de adiție a hidrogenului (H2), halogenilor (X2), a hidracizilor (HX), a apei (H2O);
- reacții de substituție cu metale din grupele 1 și 2; cu complecși ai unor metale tranziționale;
- reacții de oxidare: oxidare și ardere.
Reacția de adiție
Reacțiile de adiție sunt caracteristice alchinelor.
Adiția hidrogenului (hidrogenarea)
În funcție de catalizatorul metalic utilizat, adiția hidrogenului la acetilena, poate fi:
- hidrogenare totală, când se utilizează catalizatori de nichel (Ni), platină (Pt) sau paladiu (Pd) în exces de hidrogen și se obține etan:
- hidrogenare parțială, când se utilizează catalizator de paladiu (depus pe un suport solid) și otrăvit cu săruri de plumb (Pd/Pb2+) și se obține etenă. Reacția are loc cu randament mic, produsul de reacție majoritar fiind tot etanul.
Adiția halogenilor
ACTIVITATE EXPERIMENTALĂ
![Decolorarea soluției de [HTML]Br<sub>2</sub>[/HTML] în [HTML]CCl<sub>4</sub>[/HTML], de către acetilenă.](/content/image-upload/aditie_brom_acetilena_chimie.png)
Observații: Se remarcă decolorarea soluției de brom, deoarece acetilena adiționează bromul conform reacției chimice:
În fază gazoasă, reacția clorului cu acetilena este o reacție violentă, puternic exotermă:
Adiția hidracizilor
Reacția se desfășoară în două etape: primul produs de reacție este monohalogenoetenă și în final rezultă dihalogenoetan geminal (adică atomii de halogen se află la același atom de carbon):
În industria polimerilor, clorura de vinil este un monomer cu importanță mare.
Adiția apei (reacția Kucerov)
Omologii superiori ai acetilenei, formează cetone.
Adiția acidului acetic
Adiția acidului cianhidric
Reacția de ardere a acetilenei
Acetilena arde cu o flacără luminoasă, cu temperatură foarte înaltă. Totodată, la temperaturi înalte se degajă mult fum deoarece se formează particule fine de cărbune (C) care devin incandescente. Acestea rezultă din descompunerea termică a unei părți din acetilenă, în elemente.
Flacăra care rezultă prin arderea acetilenei se numește flacără oxiacetilenică. Aceasta atinge temperaturi de 3000°C, mult mai mari comparativ cu ale altor gaze combustibile. Flacăra oxiacetilenică obținută în suflătorul oxiacetilenic cu acetilena rezultată într-un generator de acetilenă, este folosită pentru sudura și tăierea metalelor.
Reacția de substituție
Atomii de hidrogen din molecula acetilenei, precum și cei de la capătul alchinelor marginale, prezintă caracter slab acid. Acești atomi de hidrogen pot fi înlocuiți (substituiți) cu ioni de metale, obținându-se acetiluri metalice.
Acetiluri ale metalelor din grupele I A și grupa a II-a A
Acetilena reacționează cu metalele din grupa I A (alcaline) și metalele din grupa a II-a A (alcalino-pământoase) prin reacții cu schimb de electroni.
Acetiluri ale unor metale tranziționale
Acetilena intră în reacție cu unele combinații complexe ale metalelor tranziționale Cu (I) și Ag (I) și rezultă compuși greu solubili în soluții apoase (adică se obțin precipitate).
Obținerea acetilurii de diargint
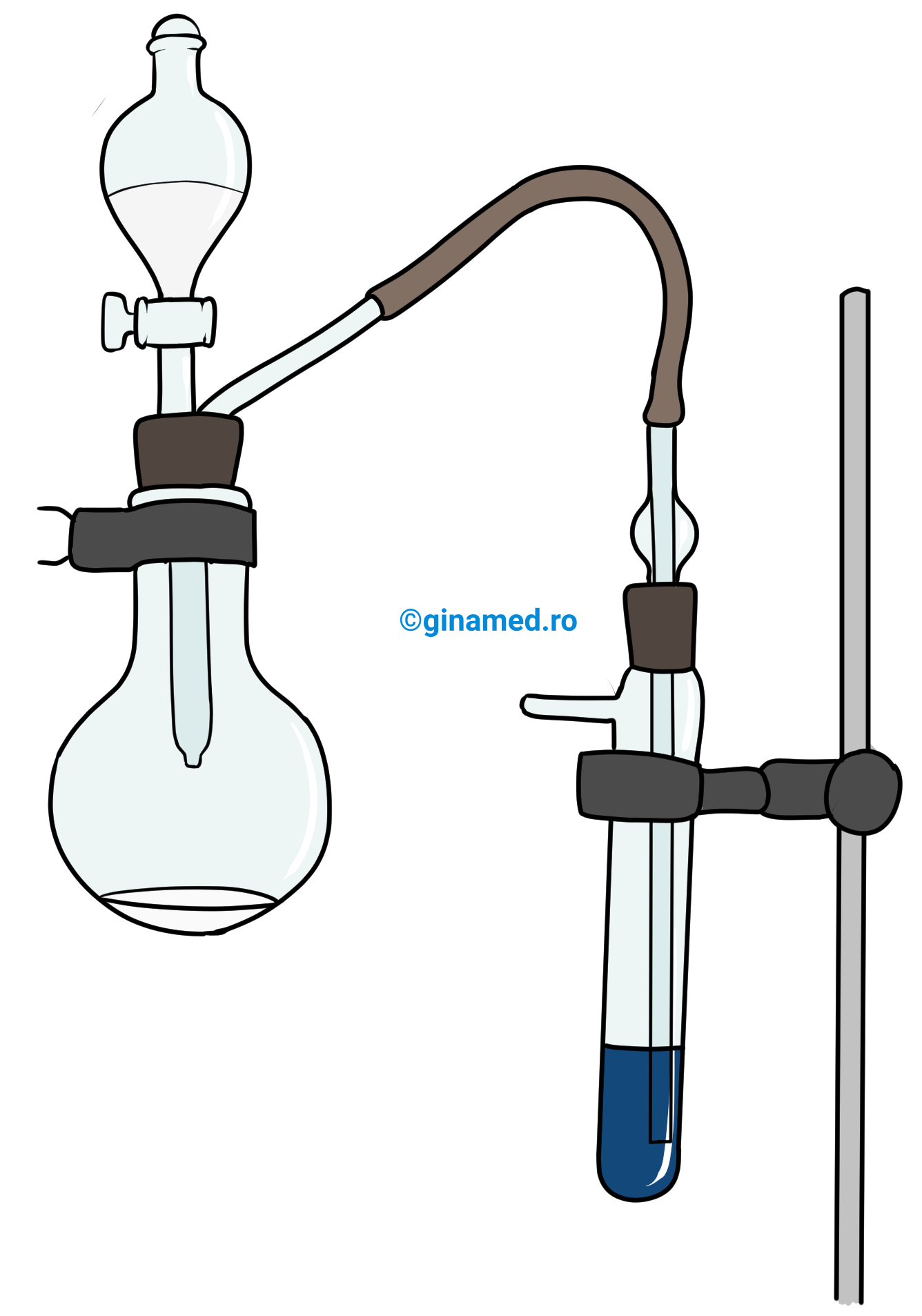
ACTIVITATE EXPERIMENTALĂ
Observații: acetilena interacționează cu reactivul Tollens și se formează un precipitat alb-gălbui de acetilură de diargint.
Ecuațiile reacțiilor chimice de preparare a reactivului Tollens și de obținere a acetilurii de diargint:
Obținerea acetilurii de dicupru (I)
ACTIVITATE EXPERIMENTALĂ
Observații: Apare un precipitat roșu brun de acetilură de dicupru (I).
Acetilurile metalelor tranziționale sunt stabile față de apă. În stare uscată, prin lovire și la încălzire, acestea sunt puternic explozive.
Formarea precipitatelor colorate de acetiluri de Cu (I) și Ag (I) se utilizează ca metodă analitică de recunoaștere a acetilenei.
5.8. Utilitatea practică a acetilenei
Utilizările practice ale acetilenei:
- sunt numeroase;
- arderea în suflătorul oxiacetilenic – sudură oxiacetilenică;
- materie primă de bază pentru obținerea de compuși organici vast utilizați;
- obținerea acetatului de vinil și a clorurii de vinil, care sunt folosiți mai departe pentru obținerea de mase plastice;
- obținerea aldehidei acetice utilizată pentru sinteza de acid acetic și alcool etilic;
- obținerea de butadienă, cloropren, acrilonitril, toate acestea utilizate pentru sinteza de cauciuc sintetic; din acrilonitril se poate obține melană (fibră textilă sintetică cu proprietăți asemănătoare lânii).
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

