4. Alchene
Cuprins:
4.1. Definiție și serie omoloagă4.2. Denumirea alchenelor
4.3. Structura alchenelor
4.4. Izomeria alchenelor
4.5. Proprietăți fizice
4.6. Proprietăți chimice
4.7. Importanța practică a alchenelor
4.8. Mase plastice
4.1. Definiție și serie omoloagă
Alchenele sunt hidrocarburi aciclice, nesaturate, care prezintă în molecula lor o legătură dublă între 2 atomi de carbon.
Seria omoloagă a alchenelor se obține prin înlocuirea lui n în formula generală a alchenelor cu valori întregi și succesive (n = 2, 3, 4, etc.), începând de la cifra 2 (n > 2). Primul termen din seria omoloagă a alchenelor este etena.
| Formula Lewis a etenei | Formula de proiecție a etenei |
|---|---|
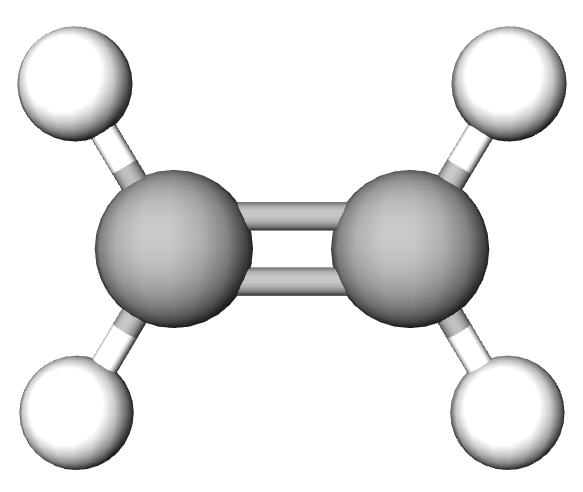
4.2. Denumirea alchenelor
Denumirea alchenelor se realizează prin înlocuirea sufixului „-an” din denumirea alcanului, cu sufixul „-enă”. Trebuie să se țină cont de faptul că începând cu al treilea termen al seriei omoloage a alchinelor, se indică și poziția dublei legături.
Formulele și denumirile primelor 4 alchene:
| n | Formula moleculară | Formula de proiecție | Formula de structură plană | Denumire |
|---|---|---|---|---|
| 1 | C2H4 | CH2=CH2 | etenă | |
| 2 | C3H6 | CH2=CH–CH3 | propenă | |
| 3 | C4H8 | CH2=CH–CH2–CH3 | 1-butenă | |
| 4 | C4H8 | CH3–CH=CH–CH3 | 2-butenă |
Regulile IUPAC stabilite pentru alcani se aplică și în denumirea alchenelor cu catenă ramificată, însă se mai adaugă următoarele:
- catena de bază trebuie să conțină legătura dublă, chiar dacă ar exista o altă catenă cu număr mai mare de atomi de carbon, dar fără legătură dublă:
Primul exemplu este corect pentru că acesta prezintă cea mai lungă catenă cu dublă legătură.
- numerotarea catenei de bază se face în așa fel încât unui atom de carbon din legătura dublă să i se atribuie numărul cel mai mic:
Se alege ca răspuns corect primul exemplu în care legătura dublă se află la atomul de carbon 2.
În baza regulilor menționate la alcani se face denumirea radicalilor derivați de la alchene. Sunt radicali care prezintă și denumiri uzuale, cum ar fi:
| Denumire radicali | Denumire uzuală a radicalilor | Structura chimică |
|---|---|---|
| etenil | vinil | CH2=CH– |
| propenil | alil | CH2=CH–CH2– |
În cazul formulei de mai sus, ar fi două posibilități de numerotare, dar conform regulilor menționate la alcani, alegem să includem în catena de bază, catena care prezintă cele mai multe ramificații: 2-hexenă. Și atunci denumirea compusul de mai sus este: 4,5-dimetil-3-propil-2-hexenă.
4.3. Structura alchenelor
Pentru a înțelege mai bine formarea acestei legături trebuie să ne reamintim structura învelișului de electroni al atomului de carbon în stare fundamentală. Cu scopul de a forma legături chimice stabile, atomul de carbon trece din starea fundamentală în starea de valență. Această trecere are loc prin combinarea orbitalilor de tip s și p din stratul 2 al stării fundamentale și formarea unor noi orbitali. Acești noi orbitali prezintă toți geometrie și energie identice, dar care diferă complet de cele ale orbitalilor s și p.
![a. Structura învelișului de electroni al atomului de carbon; b. Formarea celor 3 orbitali [HTML]sp<sup>2</sup>[/HTML].](/content/image-upload/orbitali_sp2_carbon_chimie.png)
![a. Geometria orbitalilor [HTML]sp<sup>2</sup>[/HTML]; b. Formarea legăturilor σ și π între 2 atomi de carbon; c. legăturile chimice în molecula de [HTML]C<sub>2</sub>H<sub>4</sub>[/HTML] (etenă).](/content/image-upload/geometrie_orbitali_sp2_chimie.png)
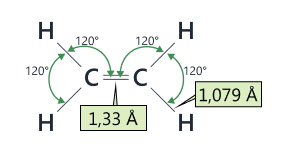
O legătură dublă se compune dintr-o legătură σ și o legătură π. Atomul de carbon implicat în dubla legătură formează 3 legături coplanare (în același plan), caracterizate de valori ale unghiurilor dintre ele de 120°.
Planul legăturii π se află perpendicular pe planul legăturii σ. În acest fel, rotația liberă în jurul legăturii duble nu este permisă, față de cazul legăturii simple C-C, în jurul căreia rotația este liberă.
Lungimea unei legături duble între 2 atomi de carbon este de 1,33 Å. Lungimea legăturii C-H în molecula etenei este de 1,079 Å.
Comparativ cu legătura σ, legătura π este mai slabă. În acest fel se justifică reactivitatea mai mare a alchenelor.
Reacțiile chimice în care sunt implicare alchenele și în care legătura π se scindează (se rupe), lasă cei 2 atomi de carbon cu câte o valență liberă, participând la formarea de noi legături σ mai stabile.
4.4. Izomeria alchenelor
Alchenele în alcătuirea cărora intră cel puțin 4 atomi de carbon, pot prezenta:
- izomeri de catenă, pentru n ≥ 4;
- izomeri de poziție, pentru n ≥ 3;
Sunt izomeri de poziție substanțele care prezintă aceeași formulă moleculară, dar diferă prin poziția unei unități structurale sau a unei grupe funcționale.
Izomeri geometrici
Faptul că planul legăturii π este perpendicular pe planul legăturii σ, rotația liberă în jurul dublei legături nu este permisă și astfel apare izomeria geometrică (pentru n ≥ 4).
O alchenă ce prezintă substituenți diferiți la fiecare dintre cei 2 atomi de carbon participanți la dubla legătură, are izomeri geometrici.
În situația în care la cei 2 atomi de carbon participanți la dubla legătură există aceeași pereche de 2 substituenți diferiți între ei, alchena prezintă 2 izomeri geometrici: cis și trans.
- CIS – când sunt situate de aceeași parte a planului dublei legături;
- TRANS – când se găsesc de părți opuse ale planului dublei legături.
În ceea ce privește 1-butena, aceasta nu prezintă izomeri geometrici. Unul dintre atomii de carbon participanți la dubla legătură prezintă 2 substituenți identici, respectiv 2 atomi de hidrogen.
4.5. Proprietăți fizice
Proprietățile fizice ale alchenelor nu diferă mult de cele ale alcanilor. Practic, alchenele prezintă proprietăți asemănătoare alcanilor cu număr similar de atomi de carbon.
Starea de agregare a alchenelor este:
- gazoasă, pentru primii termeni C2 – C4 (respectiv, etenă, propenă, cele 4 butene izomere);
- lichidă, pentru următorii termeni până la C18;
- solidă, pentru alchenele superioare (începând cu C19).
Astfel, odată cu creșterea numărului de atomi din moleculă și implicit creșterea masei moleculare a alchenei, starea de agregare variază în sensul: gaz – lichid – solid.
Punctele de fierbere (p.f.) și de topire (p.t.) ale alchenelor cresc odată (proporțional) cu creșterea masei molare a alchenei, dar puțin mai mici comparativ cu cele ale alcanilor cu număr identic de atomi de carbon.
| Alchena | p.f. °C | p.t. °C |
|---|---|---|
| etena | -103,9 | -165,5 |
| propena | -47,7 | -185,2 |
| 1-butena | -6,5 | -190 |
| cis-2-butena | +3,7 | -139,8 |
| trans-2-butena | +0,96 | -105,8 |
| izobutena | -6,6 | -140,7 |
| 1-pentena | +30,1 | -165,2 |
Densitățile alchenelor sunt mai mari decât cele ale alcanilor cu același număr de atomi de carbon.
Similar alcanilor, alchenele sunt insolubile în apă. Însă se dizolvă în solvenți organici, cum ar fi:
- cloroform;
- benzen;
- alcani.
Izomerii trans se caracterizează, în general, prin puncte de topire mai înalte și solubilități mai scăzute, comparativ cu izomerii cis.
În schimb, punctul de fierbere și densitatea izomerului cis, sunt mai înalte comparativ cu izomerul trans.
4.6. Proprietăți chimice
Pe scurt, proprietățile chimice ale alchenelor cuprind:
- reacții specifice dublei legături (sistemelor nesaturate): reacții de adiție, oxidare, polimerizare;
- reacții comune cu cele ale alcanilor: reacții de substituție, ardere.
Reacția de adiție
Adiția hidrogenului
Reacția de adiția a hidrogenului la alchene se numește reacție de hidrogenare, din care rezultă alcanii corespunzători. Această reacție necesită prezența de catalizatori metale fin divizate: Ni, Pt, Pd, la temperaturi între 80 - 180°C și presiune de 200 atm.
Reacțiile de hidrogenare sunt reacții redox.
De exemplu, prin adiția hidrogenului la etenă rezultă etan.
Modelarea catalizei eterogene de adiție a hidrogenului la etenă: modelarea moleculei de etenă în structura catalizatorului de Ni poate să fie privită la microscopul electronic.
Reacția de hidrogenare a alchenelor are loc în sistem heterogen, pentru că în condițiile de lucru:
- hidrogenul este în stare gazoasă;
- alchenele pot fi în stare gazoasă sau sub formă de soluție;
- alcanii (produșii de reacție) sunt în stare fluidă;
- catalizatorul este în stare solidă.
Adiția halogenilor
Alchenele se mai numesc olefine datorită proprietății lor de a se transforma în urma reacției de halogenare în compuși saturați cu aspect uleios.
În general, reacția de halogenare a alchenelor se desfășoară într-un solvent inert, cum ar fi:
- tetraclorură de carbon, CCl4;
- diclorometan, CH2Cl2;
- sulfură de carbon, CS2.
Adiția clorului și bromului are loc instantaneu și cantitativ, fiind utilizată pentru identificarea (recunoașterea) alchenelor și totodată pentru determinarea lor cantitativă.
ACTIVITATE EXPERIMENTALĂ
Mod de lucru: Etena se poate prepara prin deshidratarea etanolului (alcoolului etilic) care implică utilizarea unui anumit montaj.
![Instalația folosită pentru prepararea etenei și decolorarea soluției de [HTML]Br<sub>2</sub>[/HTML] în [HTML]CCl<sub>4</sub>[/HTML] (<b>înainte</b> de producerea reacției).](/content/image-upload/instalatie_preparare_etena_chimie.png)
![Instalația folosită pentru prepararea etenei și decolorarea soluției de [HTML]Br<sub>2</sub>[/HTML] în [HTML]CCl<sub>4</sub>[/HTML] (<b>după</b> producerea reacției).](/content/image-upload/instalatie_decolorare_etena_chimie.png)
Adiția hidracizilor
Hidracizii, HX (unde HX = HCl, HBr, HI) se adiționează la alchene, rezultând derivați monohalogenați saturați.
Adiția hidracizilor se poate realiza la alchene simetrice și nesimetrice.
Reactivitatea hidracizilor în reacțiile de adiția la alchene scade în ordinea: HI > HBr > HCl. Astfel, ce mai ușor se adiționează acidul iodhidric și cel mai greu acidul clorhidric.
Adiția hidracizilor la alchene nesimetrice
În ceea ce privește alchenele nesimetrice, cum ar fi propena, chiar dacă sunt două posibilități de adiție a atomilor hidracidului, rezultă întotdeauna un singur izomer.
Chimistul rus, Vladimir Vasilievivi Markovnikov (1837-1901), în anul 1870, a stabilit regula care îi poartă numele și pe baza căreia se poate prevedea felul în care se realizează adiția hidracizilor la alchenele nesimetrice.
Enunțul regulii lui Markovnikov este: Atomul de hidrogen din molecula hidracidului se fixează la atomul de carbon (participant la dubla legătură), care are cel mai mare număr de atomi de hidrogen, iar halogenul la atomul de carbon al dublei legături care are număr mai mic de atomi de hidrogen.
Adiția anti-Markovnikov
În anumite condiții, adiția poate avea loc împotriva regulii lui Markovnikov (adiție anti-Markovnikov). Astfel, în prezență de peroxizi organici (R–O–O–R), la întuneric și la cald sau la lumină și la rece, adiția acidului bromhidric (HBr) la alchenele cu dubla legătură la marginea catenei, are loc în mod invers față de regula lui Markovnikov. Acest lucru este valabil doar pentru HBr, nu și pentru acidul clorhidric (HCl) și acidul iodhidric (HI).
Adiția apei
În ceea ce privește alchenele nesimetrice, adiția apei se face conform regulii lui Markovnikov.
Reacția de polimerizare
Polimerizarea este procesul prin care mai multe molecule ale unui compus – monomer sau mer, se leagă între ele și formează o macromoleculă, denumită polimer.
În limba greacă, poly = numeros, meros = parte.
Gradul de polimerizare, n, reprezintă numărul de molecule de monomer care formează polimerul.
Alchenele prezintă capacitatea de a se uni între ele cu scopul de a forma molecule compuse din unități identice care se repetă de zeci, sute sau mii de ori, denumite macromolecule (sau mase plastice).
Reacția de polimerizare a alchenelor este o reacție de poliadiție (adiție repetată) care implică ruperea legăturii π din fiecare moleculă de alchenă (monomer) și formarea unor noi legături σ, C–C.
Condițiile de tip:
- temperatură;
- presiune;
- catalizatori;
- inițiatori;
- mediu de reacție;
- procedeu de polimerizare,
variază foarte mult și diferă în funcție de monomer și proprietățile pe care trebuie să le aibă polimerul. Policlorura de vinil, poliacrilonitrilul și poliacetatul de vinil se numără printre cei mai folosiți polimeri de adiție.
În urma hidrolizei grupelor esterice din poliacetatul de vinil, se formează alcoolul polivinilic.
În macromoleculele de alcool polivinilic nu sunt hidrolizate toate grupele esterice. Astfel, numărul de grupe acetat nehidrolizate influențează proprietățile și utilizările alcoolului polivinilic. Alcoolul polivinilic este un compus macromolecular solid, de culoare albă, solubil în apă, glicol, glicerină. Se folosește ca emulgator, ca adeziv (aracetul), precum și în alte domenii.
Problemă rezolvată
Prin polimerizarea a 2 kg de etenă se obţine polietena cu masa molară 42000 g/moI. Ştiind că doar 80% din etena introdusă polimerizează se cere:
a. Scrie ecuația reacției chimice care are loc;
b. Calculează gradul de polimerizare al polietenei;
c. Calculează masa de polietenă obținută.
Rezolvare:
c. În cadrul unei reacții de polimerizare care are loc cu un randament de 100%, se poate considera că masa de monomer este egală cu masa de polimer obținută.
Reacții de oxidare
Comparativ cu alcanii, alchenele se oxidează mai ușor. Reacțiile de oxidare a alchenelor se desfășoară sub acțiunea agenților oxidanți. Astfel, în funcție de agentul oxidant și condițiile de lucru, reacțiile de oxidare a alchenelor se desfășoară într-un mod diferit, ducând la compuși diferiți.
Oxidarea blândă
Reacția de oxidare blândă a alchenelor are loc în soluție apoasă neutră sau slab bazică de permanganat de potasiu (reactiv Bayer).
Acțiunea agentului oxidant rupe legătura π din legătura dublă a alchenelor și formează dioli. Diolii sunt compuși care prezintă două grupări hidroxil (–OH) la cel 2 atomi de carbon vecini (dioli vicinali). Prin ruperea legăturii π în cadrul acestei reacții, la fel ca și în reacția de adiție, rezultă un compus saturat stabil.
ACTIVITATE EXPERIMENTALĂ
![Instalația folosită pentru reacția etenei cu [HTML]KMnO<sub>4</sub>[/HTML] în mediu neutru sau bazic (<b>înainte</b> de producerea reacției).](/content/image-upload/instalatia_etena_permanganat_chimie.png)
![ Instalația folosită pentru reacția etenei cu [HTML]KMnO<sub>4</sub>[/HTML] în mediu neutru sau bazic (<b>după</b> producerea reacției se remarcă decolorarea soluției de [HTML]KMnO<sub>4</sub>[/HTML] și apariția unui precipitat brun de dioxid de mangan). ](/content/image-upload/instalatia_etena_precipitat_chimie.png)
Pe lângă forma simplificată, ecuațiile reacțiilor chimice de oxidare a alchenelor se pot scrie și complet. În acest fel sunt evidențiați reactivii, produșii de reacție și sunt precizați coeficienții stoechiometrici.
Pentru calcularea coeficienților în ecuațiile reacțiilor chimice sunt necesare cunoștințe ce privesc echilibre cu transfer de electroni.
Pentru stabilirea numerelor de oxidare ale atomilor de carbon din compușii organici, se aplică următoarea regulă: Fiecare atom de carbon dintr-un compus organic, împreună cu substituenții lui (exclusiv/se exclud alți atomi de carbon) este considerat o entitate în care suma algebrică a numerelor de oxidare alte tuturor elementelor componente este 0 (zero).
Se poate proceda în felul următor:
- pentru fiecare legătură C–H, atomului de C i se atribuie numărul de oxidare (N.O.): –1;
- pentru fiecare legătură C–C, atomului de C i se atribuie numărul de oxidare (N.O.): 0;
- pentru fiecare legătură C–heteroatom, atomului de C i se atribuie numărul de oxidare (N.O.): +1.
Stabilirea coeficienților stoechiometrici
Pentru stabilirea coeficienților stoechiometrici se urmează etapele:
1. Se scrie ecuația reacției redox fără coeficienți:
2. Se stabilește N.O. pentru fiecare atom din fiecare compus (și anume, reactivi și produși de reacție redox):
3. Se identifică atomii a căror N.O. se modifică și se scriu separat procesele parțiale (semireacțiile) de oxidare și de reducere care au loc:
4. Se echilibrează semireacțiile scrise în etapa anterioară, ținând cont de legea conservării masei și a sarcinii electrice și de faptul că numărul electronilor cedați în procesul de oxidare trebuie să fie egal cu cel al electronilor acceptați în procesul de reducere:
5. Se scriu coeficienții determinați pentru cele două semireacții drept coeficienți ai speciilor oxidante și reducătoare participante la reacția redox:
6. Se calculează coeficienții celorlalte specii chimice participante la reacție pe baza legii conservării masei:
Oxidarea energică
ACTIVITATE EXPERIMENTALĂ
![Reacția etenei în mediu acid cu soluție de [HTML]KMnO<sub>4</sub>[/HTML] (se decolorează soluția).](/content/image-upload/etena_mediu_acid_chimie.png)
![În dreapta este culoarea soluției de [HTML]K<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub>[/HTML] (portocalie), iar în stânga este culoarea soluției (verde) care conține [HTML]Cr<sup>3+</sup>[/HTML] după oxidarea etenei.](/content/image-upload/crom_dupa_oxidare_etena_chimie.png)
Etena a reacționat cu soluțiile de agenți oxidanți în mediu acid, conform reacțiilor chimice:
Deci, oxidarea energică a alchenelor se face cu:
- K2Cr2O7 în H2SO4 (dicromat de potasiu în acid sulfuric) sau
- KMnO4 în H2SO4 (permanganat de potasiu în acid sulfuric).
În urma acțiunii agenților oxidanți, legătura dublă C = C se rupe și se obțin amestecuri de diferiți produși de oxidare, în funcție de structura inițială a alchenei, astfel:
- atunci când atomul de C implicat în legătura dublă conține hidrogen, rezultă un acid carboxilic: R–COOH.
- când atomul de C implicat în legătura dublă se află la capătul catenei (deci prezintă 2 atomi de hidrogen), radicalul se oxidează până la CO2 și H2O.
- când atomul de C implicat în legătura dublă nu conține hidrogen, rezultă un compus carbonilic – o cetonă: R – CO – R.
Problemă rezolvată
Rezolvare:
Se scrie ecuația reacției de oxidare și se stabilesc coeficienții:
Oxidarea etenei cu oxigen
Industrial, prin oxidarea etenei cu oxigen, la 250-400°C, în prezență de argint (Ag) drept catalizator, se obține oxidul de etenă (etilenoxidul).
Etilenoxidul se caracterizează prin:
- are punctul de fierbere: +12°C;
- se conservă în cilindri de oțel;
- este toxic;
- este materie primă pentru numeroase sinteze;
- se folosește ca insecticid pentru gazarea spațiilor închise.
Oxidarea completă (arderea)
Alchenele ard în oxigen sau în aer. Alchenele se oxidează complet până la dioxid de carbon și apă, cu eliberare de energie, Q.
La temperatura de ardere, alchenele pot fi implicate în reacții de polimerizare, ceea ce nu permite utilizarea lor ca și combustibili. Din același motiv trebuie evitată prezența lor în benzină.
Reacția de substituție
Reacția de halogenare în poziția alilică
Reacțiile de substituție nu sunt caracteristice alchenelor, ci hidrocarburilor saturate. Cu toate acestea, la temperatură ridicată are loc substituția unor atomi de hidrogen (a celor mai reactivi) din catena saturată a alchenelor, cu atomi de clor sau de brom.
Atomii de hidrogen de la un atom de carbon legat de un atom de carbon implicat într-o legătură dublă, adică din poziție alilică (sau poziția vecină dublei legături) au o reactivitate mai mare comparativ cu atomii de hidrogen de la ceilalți atomi de carbon din catena unei alchene.
La tratarea unor alchene inferioare cu clor sau brom la temperaturi ridicate (de 500-600°C), are loc substituția atomului de H aflat în poziția alilică. Astfel, rezultă un compus monohalogenat nesaturat.
4.7. Importanța practică a alchenelor
Etena și propena sunt alchene care prezintă cele mai numeroase direcții de valorificare practică. Acestea sunt utilizate ca:
- materii prime pentru obținerea altor compuși chimici, cu ar fi: etanol, propanol, etilenglicol (utilizat ca antigel), glicerina (utilizată în industria farmaceutică și cosmetică), solvenți, acid acetic;
- stimulatori ai proceselor vegetative: etena grăbește încolțirea semințelor, dar și înflorirea și coacerea fructelor și legumelor;
- monomeri pentru obținerea de mase plastice; etena și propena sunt monomeri pentru obținerea polietenei, respectiv polipropenei;
Mai specific, etena poate fi folosită pentru obținerea:
- polietenei;
- clorurii de vinil;
- 1,2 dicloroetan, din care se obține clorura de vinil și mai departe PVC (policlorura de vinil);
- derivați halogenați;
- oxidului de etenă;
- etandiol (etilenglicol), utilizat ca lichid anticongelant (antigel) și în industria firelor și a fibrelor sintetice;
- etanol, care este utilizat în industria cosmetică, farmaceutică, pentru obținerea de solvenți, băuturi alcoolice.
4.8. Mase plastice
Introducere
Masele plastice sunt produse tehnologice de sinteză în alcătuirea cărora intră un compus macromolecular sintetic și alte substanțe (cum ar fi plastifianți, coloranți, antioxidanți) adăugate cu scopul de a le conferi proprietăți superioare.
Compușii macromoleculari se mai numesc și mase plastice. Aceștia au rolul de a înlocui metalele, lemnul, pielea, în fabricarea unor articole tehnice, ambalaje, îmbrăcăminte, etc. Dar totodată, compușii macromoleculari pot fi încadrați ca materiale noi care prezintă proprietăți superioare compușilor naturali, cu largă utilizare, atât în industrie, cât și în viața de zi cu zi.
Raportat la materialele pe bază de produse din natură, sub aspectul funcționalității lor, masele plastice prezintă avantaje și dezavantaje.
Avantajele maselor plastice:
- prezintă proprietăți optice superioare;
- prezintă rezistența mecanică și la acțiunea altor agenți chimici;
- sunt izolatori chimici și termici;
- prezintă un preț de cost redus;
- prezintă elasticitate.
Dezavantajele maselor plastice:
- sunt poluanți;
- îmbătrânesc;
- prezintă rezistență și conductivitate scăzute;
- dezavantaj major: nu sunt biodegradabile. Astfel, obiectele din materiale plastice utilizate trebuie colectate separat și distruse sau reciclate industrial.
Corelația proprietăți – utilizare trebuie avută în vedere la utilizarea unui polimer, deoarece o anumită proprietate a maselor plastice se poate transforma în avantaj sau dezavantaj. Calitatea de izolant termic, de exemplu, reprezintă un avantaj când vorbim despre utilizarea polimerului la confecționarea de tâmplărie de tip termopan. Însă, atunci când polimerul este utilizat în acoperirea la interior a vaselor de bucătărie, unde transferul termic constituie o condiție a utilizării, reprezintă un dezavantaj.
Clasificarea maselor plastice
În funcție de comportarea la deformare, masele plastice pot fi:
- plastomeri – pot fi deformate permanent;
- elastomeri – pot fi deformate temporar, deoarece prezintă elasticitate mare.
În funcție de comportarea la încălzire, masele plastice pot fi:
- termoplaste – la încălzire se înmoaie, iar la răcire se întăresc;
- termorigide – se prelucrează doar la rece, deoarece prin încălzire nu se topesc.
Principalii monomeri vinilici (etena și principalii monomeri derivați din ea) și polimerii proveniți din aceștia:
| Formulă monomer | Denumire monomer | Formulă polimer | Denumire polimer |
|---|---|---|---|
| etenă | polietenă | ||
| propenă | polipropenă | ||
| stiren | polistiren | ||
| clorură de vinil | policlorură de vinil (PVC) | ||
| tetrafluoroetena | politetrafluoroetena (teflon) |
Aplicații practice
Polietena se caracterizează prin:
- este produsul de polimerizare a etenei;
- gradul de polimerizare variază în limite foarte mari: n = 18.000 – 800.000);
- dependent de presiune (5-1500 atm) și restul condițiilor de fabricație, rezultă polietenă cu grade diferite de polimerizare și implicit proprietăți diferite;
- presiunea de polimerizare este invers proporțională cu densitatea și elasticitatea polimerului;
- presiunea de polimerizare este direct proporțională cu rezistența polimerului la agenți chimici;
- este utilizată la izolarea conductorilor și cablurilor electrice;
- este utilizată la fabricarea de tuburi, ambalaje și obiecte de uz casnic;
- este utilizată pentru protejarea suprafețelor împotriva coroziunii;
- este utilizată pentru producția de ambalaje alimentare și farmaceutice.
Polipropena se caracterizează prin:
- prezintă proprietăți și utilizări asemănătoare polietenei;
- poate fi trasă în fire;
- poate fi folosită pentru obținerea de folii, cutii, flacoane, seringi;
- se recomandă utilizarea ei pentru articole care vin în contact cu alcoolul etilic concentrat.
Polistirenul se caracterizează prin:
- este un polimer cu proprietăți dielectrice foarte bune;
- este stabil la acțiunea variaților agenți chimici;
- este folosit pentru obținerea polistirenului expandat și a unei game largi de articole de uz casnic sau de interes sanitar și igienic;
Polistirenul expandat rezultă prin tratarea perlelor de polistiren cu n-butan sub presiune, urmată de încălzirea lor, când are loc expandarea, adică creșterea diametrului perlelor, sudându-se între ele. Rezultă un produs sub formă de blocuri care este mai ușor decât pluta. Polistirenul expandat este utilizat la ambalaje pentru piese casabile sau deformabile și ca material izolator termic și fonic.
Policlorura de vinil (PVC) se caracterizează prin:
- masa sa moleculară variază între: 18.000 - 30.000;
- este o masă solidă, relativ dură;
- se înmoaie la 90-95°C și se descompune la temperaturi mai ridicate;
- este solubilă în cetone, compuși halogenați și esteri;
- este folosită pentru obținerea de tuburi, conducte și țevi pentru instalații sanitare;
- este folosită pentru obținerea unor foi (folii), care pot avea sau nu suport textil (covoare pentru pardoseli: linoleum, mușamale);
- este folosit la fabricarea înlocuitorilor din piele pentru încălțăminte și marochinărie;
- articolele în alcătuirea cărora intră prezintă rezistență la acțiunea agenților chimici și atmosferici; nu prezintă rezistență la încălzire;
- imprimă un caracter izolant termic și electric articolelor în alcătuirea cărora intră (aparate electrotehnice); izolează cablurile electrice;
- intră în alcătuirea jucăriilor;
- intră în alcătuirea tâmplăriei termopan.
Politetrafluoroetena (teflonul) se caracterizează prin:
- este foarte bun izolator electric;
- se utilizează în industria chimică și aeronautică, sub formă de piese sau straturi izolatoare, care funcționează în medii corozive sau la temperaturi ridicate;
- este inert la acțiunea agenților chimici, chiar și la temperatură ridicată;
- nu este inflamabil;
- din punct de vedere practic, proprietățile sale sunt valorificate în fabricarea de vase de bucătărie ce prezintă partea interioară acoperită cu un strat subțire de teflon.
Poliacrilonitrilul (PNA) se caracterizează prin:
- este un polimer sintetic obținut prin polimerizarea acrilonitrilului;
- masa sa moleculară variază între: 35.000 - 50.000;
- este folosit pentru obținerea fibrelor sintetice;
- fibrele acrilice manifestă rezistență mare la purtare, elasticitate, flexibilitate, rezistență la produse chimice și un tușeu bun;
- față de fibrele naturale, nu sunt hidroscopice (nu rețin apa).
Poliacetatul de vinil (PAV) se caracterizează prin:
- rezultă prin polimerizarea acetatului de vinil;
- masa moleculară variază între: 10.000 - 100.000;
- este o substanță solidă, netoxică, termoplastică;
- este insolubilă în apă;
- este solubilă în solvenți organici (alcool, benzen, compuși halogenați, cetone, etc.);
- se folosește pentru obținerea unor lacuri, emailuri, adezivi, apreturi textile.
Alte informații:
- poli(2-metil-propena) sau ca poli(izo-butenă) reprezintă componentul principal al produselor utilizate la depoluarea deversărilor de fracțiuni petroliere. În apele marine, acest polimer se îmbibă cu fracțiuni petroliere, formând o masă vâscoasă, ce plutește la suprafața apei un timp îndelungat, putând fi ușor îndepărtată. Avantajul metodei constă în aceea că polimerul poate fi regenerat, iar fracțiunile petroliere înglobate pot fi recuperate prin distilarea acestora din amestecul rezultat la depoluare.
- unii polimeri pot prezenta o conductivitate termică de cel puțin 200 de ori mai mică decât a oțelului.
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

