3. Alcani
Cuprins:
3.1. Definiție și serie omoloagă3.2. Denumirea alcanilor
3.3. Izomeria alcanilor
3.4. Denumirea alcanilor cu catenă ramificată
3.5. Structura alcanilor
3.6. Proprietăți fizice
3.7. Proprietăți chimice
3.8. Acțiunea alcanilor asupra mediului și asupra oamenilor
3.1. Definiție și serie omoloagă
Alcanii sunt hidrocarburi aciclice saturate.
Moleculele alcanilor conțin doar legături simple de tip σ (sigma) care se stabilesc între carbon-carbon și carbon-hidrogen.
3.2. Denumirea alcanilor
În seria omoloagă a alcanilor, primii 4 termeni prezintă denumiri specifice, uzuale care prezintă terminația (sufixul) „-an”. Primul termen este metanul, urmat de etan, propan, butan.
Formulele și denumirea primilor 4 alcani cu formulele moleculare și denumirile alcanilor C5-C11; C20:
| n | Formula moleculară | Formula de proiecție | Formula de structură plană | Denumire |
|---|---|---|---|---|
| 1 | CH4 | CH4 | metan | |
| 2 | C2H6 | CH3–CH3 | etan | |
| 3 | C3H8 | CH3–CH2–CH3 | propan | |
| 4 | C4H10 | CH3–CH2–CH2–CH3 sau | butan | |
| 5 | C5H12 | pentan | ||
| 6 | C6H14 | hexan | ||
| 7 | C7H16 | heptan | ||
| 8 | C8H18 | octan | ||
| 9 | C9H20 | nonan | ||
| 10 | C10H22 | decan | ||
| 11 | C11H24 | undecan | ||
| 20 | C20H42 | eicosan |
| Formula Lewis a metanului | Formula de proiecție a metanului |
|---|---|
Pentru denumirea compușilor organici, se aplică regulile stabilite de IUPAC (Uniunea Internațională de Chimie Pură și Aplicată).
Cel de-al cincilea termen din seria omoloagă a alcanilor este primul a cărui denumire de compune din adăugarea sufixului „-an” la cuvântul grecesc care indica numărul de atomi de carbon din moleculă. De exemplu: pentan, hexan, heptan, etc.
Completare: De exemplu, omologul superior al pentanului este hexanul, iar omologul inferior este butanul.
3.3. Izomeria alcanilor
Introducere
Substanțele care prezintă aceeași formulă moleculară, însă diferă prin structura lor și implicit prin proprietățile lor, poartă numele de izomeri.
| n-butan | i-butan |
|---|---|
| C4H10 | C4H10 |
| CH3–CH2–CH2–CH3 |
Alcanii se diferențiază în funcție de tipul catenei în:
- alcani cu catene liniare – denumiți uzual, normal alcani sau n-alcani;
- alcani cu catene ramificate – denumiți izoalcani sau i-alcani.
Substanțele izomere care se diferențiază doar prin modul de aranjare a atomilor de carbon în catene liniare sau ramificate, poartă numele de izomeri de catenă. De exemplu, n-butan și izobutanul sunt izomeri de catenă.
În seria alcanilor, concomitent cu creșterea numărului de atomi de carbon, crește și numărul izomerilor de catenă care corespund aceleiași formule moleculare.
Numărul de izomeri de catenă care corespund alcanilor cu C4-C7 și C10:
| Formula moleculară | Nr. de izomeri de catenă |
|---|---|
| C4H10 | 2 |
| C5H12 | 3 |
| C6H14 | 5 |
| C7H16 | 9 |
| C10H22 | 75 |
Denumirea izoalcanilor
Pentru denumirea corectă a alcanilor cu catenă ramificată trebuie să se țină cont de următoarele:
- respectarea unor reguli generale impuse de IUPAC;
- cunoașterea numelor catenelor care reprezintă ramificațiile legate de catena de bază. Ramificațiile catenei de bază poartă numele radicalilor hidrocarbonați (radicali de hidrocarbură) corespunzători.
Radicalul hidrocarbonat sau radicalul de hidrocarbură rezultă, în mod formal, prin îndepărtarea unuia sau a mai multor atomi de hidrogen (H) dintr-o hidrocarbură.
Denumirea radicalilor hidrocarbonați proveniți de la alcani se realizează prin înlocuirea sufixului „-an” din numele alcanului, cu sufixul corespunzător numărului de atomi de H (hidrogen) îndepărtați de la atomul de C (carbon).
Astfel, prin îndepărtarea:
- unui atom de hidrogen, sufixul „-an” din denumirea alcanului este înlocuit cu sufixul „-il”, rezultând radicali monovalenți, care mai poartă numele de radicali alchil.
- a 2 atomi de hidrogen, sufixul „-an” din denumirea alcanului este înlocuit cu sufixul „-iliden” sau „ilen”, rezultând radicali divalenți alchiliden sau alchilen.
- a 3 atomi de hidrogen, sufixul „-an” din denumirea alcanului este înlocuit cu sufixul „-ilidin” sau „-in”, rezultând radicali trivalenți alchilidin sau alchin.
Radicalii hidrocarbonați care provin de la metan:
| Metan | Metil | Metiliden (metilen) | Metilidin (metin) |
|---|---|---|---|
| CH4 |
3.4. Denumirea alcanilor cu catenă ramificată
Pentru denumirea alcanilor cu catenă ramificată se respectă următoarele reguli:
1. Se stabilește care este cea mai lungă catenă de atomi de carbon, aceasta considerându-se a fi catena de bază.
Prima este alegerea corectă pentru că cea mai lungă catenă prezintă 7 atomi, față de a doua situație în care catena cea mai lungă este formată din 6 atomi de carbon.
Observație: În cazul în care există două catene cu număr identic de atomi de carbon, catena de bază va fi cea care prezintă cele mai multe ramificații.
În ambele cazuri catena cea mai lungă este alcătuită din 6 atomi de carbon, însă în primul exemplu se consideră a fi alegerea corectă pentru că prezintă 3 ramificații, față de două, cum se întâlnesc în cel de-al doilea exemplu.
2. După identificarea catenei de bază, se numerotează atomii de carbon din alcătuirea acesteia, folosind cifre arabe. Aceste cifre constituie indicii de poziții ale ramificațiilor catenei. Numerotarea se poate începe de la o extremitate sau alta a catenei. Varianta corectă însă, este cea în care suma indicilor de poziție a tuturor ramificațiilor este minimă (cea mai mică).
În primul exemplu, suma indicilor de poziție a ramificațiilor este 9 (adică 2+3+4), față de cel de-al doilea exemplu unde suma este 12 (adică, 3+4+5). Deci alegerea primul exemplu este corect.
3. În completarea numelui alcanului care corespunde catenei de bază, se adaugă numele ramificațiilor (radicalilor), în ordine alfabetică, indicând:
- prin cifre arabe pozițiile ramificațiilor (radicalilor);
- prin prefixele: di-, tri-, tetra-, penta-, etc, multiplicitatea lor pe catenă. Ordinea alfabetică a ramificațiilor nu este modificată de prefixe.
Denumirea corectă este cea de „3-etil-2,4-dimetilhexan” (primul exemplu), nu „2,4-dimetil-3-etilhexan” (al doilea exemplu).
În unele cazuri, sunt hidrocarburi care pe lângă denumirile IUPAC mai prezintă și denumiri uzuale. Astfel:
- pentru alcanii care prezintă o grupă metil la cel de-al doilea atom de carbon al catenei de bază, se recurge la folosirea prefixului „izo-„ adăugat la numele n-alcanului izomer, în locul lui n:
- pentru alcanii care prezintă două grupe metil la cel de-al doilea atom de carbon al catenei de bază, se recurge la folosirea prefixului „neo-„ adăugat la numele n-alcanului izomer, în locul lui n:
Structura grupelor de atomi cărora le corespund prefixe folosite în denumirea alcanilor care le conțin:
| neo | izo |
|---|---|
3.5. Structura alcanilor
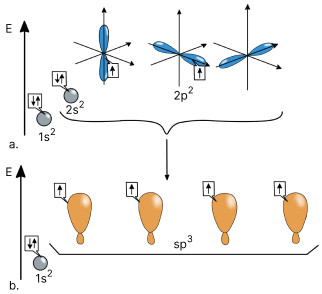
Se observă că atomul de carbon prezintă pe ultimul strat 4 electroni, distribuiți astfel:
- 2 în orbitali de tip s și au spin opus;
- 2 în orbitali de tip p și au spin paralel.
În cazul în care atomul de carbon ar participa la formarea de legături chimice doar cu cei 2 orbitali de tip p, atunci carbonul ar avea valența 2 în compușii săi. Însă, în realitate, în toți compușii săi organici, atomul de carbon are valența 4.
Cu scopul de a forma legături chimice stabile, atomul de carbon trece din starea fundamentală în starea de valență. Această trecere are loc prin combinarea orbitalilor de tip s și p din stratul 2 al stării fundamentale și formarea unor noi orbitali. Acești noi orbitali prezintă toți geometrie și energie identice, dar care diferă complet de cele ale orbitalilor s și p.
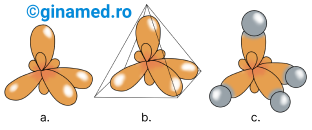
Toți alcanii prezintă legături simple σ care se stabilesc între doi atomi de carbon, dar și între atomii de carbon și hidrogen. Lungimea legăturii simple C–C este de 1,54 Å, cu posibilitatea efectuării unei rotații în jurul acestei legături (pentru că unghiul dintre două valențe este de 109°28’).
Alcanii care prezintă catene mai mari de 3 atomi de carbon prezintă o structură în formă de zig-zag dată de orientarea tetraedrică a valențelor atomilor de carbon.
3.6. Proprietăți fizice
Starea de agregare
Punctele de fierbere și de topire
Punctele de fierbere și de topire ale normal alcanilor variază în funcție de:
- numărul de atomi de carbon din moleculă sau
- valoarea masei molare.
Astfel, punctele de fierbere și de topire cresc proporțional cu creșterea numărului de atomi de carbon din moleculă. Totodată, creșterea punctelor de fierbere este mai constantă (mai uniformă), comparativ cu creșterea punctelor de topire, dependent de creșterea numărului de atomi de carbon din moleculă.
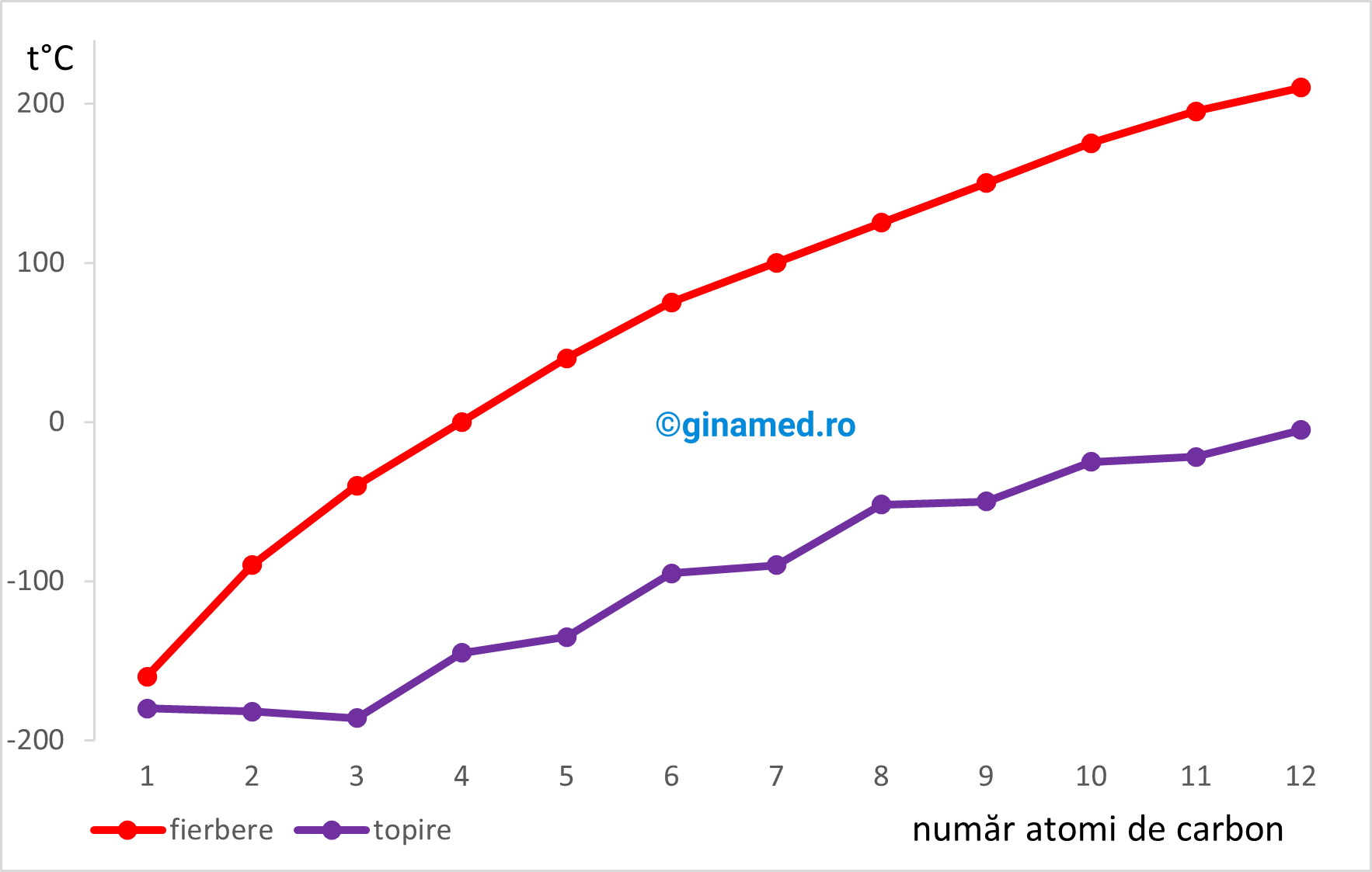
În ceea ce privește izoalcanii, aceștia prezintă puncte de fierbere mai scăzute comparativ cu normal-alcanii cu același număr de atomi de carbon.
Pentru alcanii care prezintă același număr de atomi de carbon, izomerul cu catena cea mai ramificată prezintă punctul de fierbere cel mai scăzut. Deci, odată cu creșterea ramificației catenei, punctul de fierbere scade. De exemplu, n-pentan are punctul de fierbere de 36,1°C, izo-pentan de 27,8°C, iar neo-pentan de 9,4°C.
Valorile punctelor de fierbere ale unor alcani:
| Nume | Structură | Valoare punct de fierbere |
|---|---|---|
| N-octan | 127,7°C | |
| N-pentan | 36,1°C | |
| Izo-pentan | 27,8°C | |
| Neo-pentan | 9,4°C | |
| 2,2,3,3-tetrametilbutan | 106,3°C |
Solubilitate și densitate
ACTIVITATE EXPERIMENTALĂ
Observații: În urma activității experimentale se observă că vaselina plutește deasupra apei pentru că nu se dizolvă în apă și prezintă o densitate mai scăzută decât a apei. Vaselina se dizolvă în benzină și în tetraclorură de carbon.
Astfel, alcanii au molecule nepolare și se dizolvă în solvenți nepolari, care la rândul lor au molecule nepolare. Exemple de solvenți nepolari: benzină, tetraclorură de carbon.
Apa este un solvent polar, iar alcanii nu se dizolvă în apă.
Alcanii solizi plutesc pe apă, iar cei lichizi stau la suprafața apei, pentru că au o densitate mai mică decât a apei.
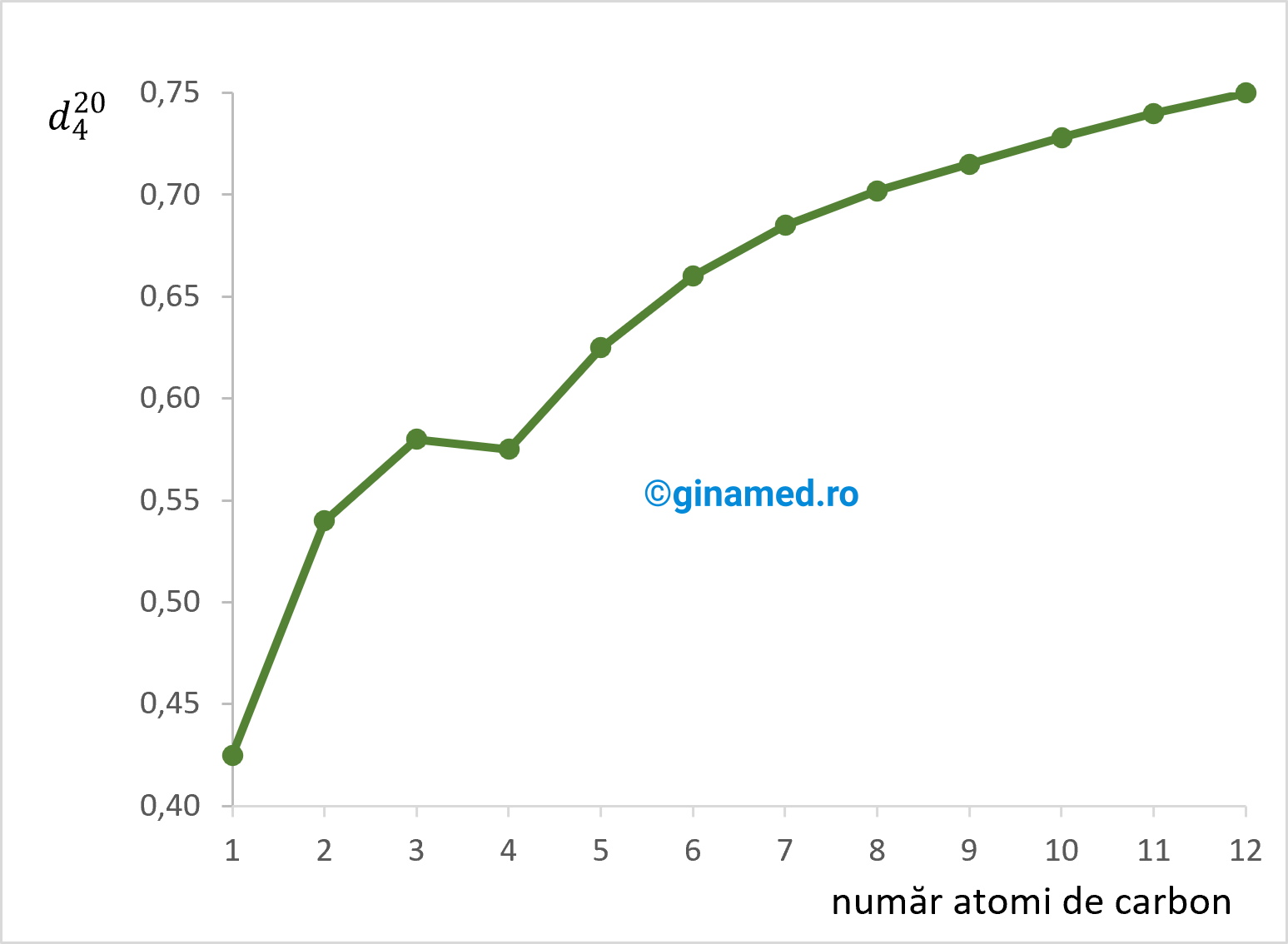
Completare: Densitatea alcanilor crește odată cu creșterea numărului de atomi de carbon din moleculă, însă valoarea rămâne tot inferioară apei.
Miros
Alcanii inferiori sunt inodori, iar alcanii superiori prezintă un miros caracteristic. Totuși, pentru a putea identifica scurgerile de gaz din conducte sau din butelii, la amestecul gazos format din alcani se adaugă compuși organici care conțin sulf în moleculă, care poartă numele de mercaptani. Aceștia se caracterizează printr-un miros neplăcut și pot fi identificați cu ușurință în cazul unor fisuri ale recipientelor transportoare.
3.7. Proprietăți chimice
Alcanii mai poartă numele de parafine, de la parum affinis care înseamnă lipsă de afinitate. Această denumire indică nereactivitatea alcanilor la temperaturi scăzute.
Moleculele alcanilor prezintă doar legături covalente simple Carbon – Carbon și Carbon – Hidrogen, ceea ce le conferă acestora o mare stabilitate chimică. Astfel, sunt necesare condiții energice care să favorizeze ruperea legăturilor σ C–C sau C–H din molecula alcanului, permițând acestuia să reacționeze.
În cursul reacției chimice la care sunt supuși alcanii, anumite legături se scindează și în funcție de tipul lor, se pot atribui proprietăți chimice ale alcanilor, precum și tipul de reacții chimice la care aceștia participă. Astfel:
- reacții care duc la scindarea legăturii C–C: cracarea, izomerizarea, arderea;
- reacții care duc la scindarea legăturii C–H: substituția, dehidrogenarea, oxidarea.
Reacția de substituție
Reacția de substituție este o reacție chimică ce caracterizează substanțele organice care conțin legături simple σ în moleculă. În cadrul unei reacții de substituție, unul sau mai mulți atomi de hidrogen sunt înlocuiți (substituiți) cu unul sau mai mulți atomi sau grupe de atomi.
Reacția de halogenare
Alcanii reacționează direct cu clorul și bromul, în următoarele condiții:
- la lumină (fotochimic, lumină solară, lumina unui bec puternic, lumina ultravioletă) sau
- la întuneric și temperaturi ridicate (încălzire termică la 300 – 400°C, 300 – 600°C).
Clorurarea fotochimică a metanului duce la formarea unui amestec de derivați clorurați:
- clorometan (clorură de metil)
- diclorometan (clorură de metilen)
- triclorometan (clorură de metin, cloroform)
- tetraclorometan (tetraclorură de carbon)
Spre deosebire de reacția de clorurare, fluorurarea și iodurarea alcanilor au loc în mod indirect.
Pentru alcanii care prezinta atomi de hidrogen echivalenți între ei, prin reacția de halogenare va rezulta un singur compus monohalogenat.
Monohalogenarea alcanilor care prezintă mai mult de 2 atomi de carbon în moleculă (începând cu propanul) determină obținerea de amestecuri de compuși monohalogenați care sunt izomeri de poziție. Astfel, la alcanii superiori, începând cu propanul, reacția de halogenare este neorientată, adică poate fi substituit hidrogenul de la oricare atom de carbon.
Prin monoclorurarea fotochimică a propanului rezultă un amestec de izomeri monoclorurați:
- 1-cloropropan (clorură de propil):
- 2-cloropropan (clorură de izopropil):
Proporția izomerilor de poziție din amestecul final rezultat prin halogenarea alcanilor, depinde de:
- reactivitatea atomului de hidrogen;
- reactivitatea halogenului;
- temperatura de lucru.
Energia de legătură se referă la energia care se absoarbe la ruperea unei legături. În funcție de valoarea acestei energii, se poate aprecia tăria unei legături. În acest fel, legăturile slabe sunt caracterizate de energii de legătură mici:
- legătura C–H din (CH3)3C–H are energia de legătură de 85 kcal/mol;
- legătura C–H din (CH3)2CH–H are energia de legătură de 89 kcal/mol;
- legătura C–H din CH3-CH2-CH2–H are energia de legătură de 95 kcal/mol.
Clorul este mai activ decât bromul. În acest fel, clorul va ataca toți atomii de hidrogen, pe când bromul va ataca atomii de hidrogen mai reactivi. Din acest motiv, compușii bromurați secundari și terțiari se formează în proporție mai mare comparativ cu compușii clorurați corespunzători.
În ambele reacții de mai sus intervine și temperatura și influențează compoziția amestecului de reacție.
În baza celor menționate mai sus, bromurarea izobutanului se desfășoară la 130°C și se obțin compuși monobromurați, dintre care în proporția cea mai mare rezultă 2-bromo-izobutan (99%) și 1-bromo-izobutan (1%).
Reacția de izomerizare
Reacțiile de izomerizare sunt reacții în urma cărora n-alcanii se transformă în izoalcani și invers, rezultând un amestec de hidrocarburi izomere. Reacțiile de izomerizare sunt reversibile.
Reacțiile de transpoziție constau în migrarea unor atomi sau grupe de atomi dintr-o parte a moleculei în alta. Izomerizarea alcanilor este un exemplu de reacție de transpoziție deoarece n-alcanii trec în izomeri cu catenă ramificată.
Reacțiile de izomerizare se desfășoară în prezența unuia dintre catalizatori:
- AlCl3 (clorură de aluminiu) umedă, la temperaturi relativ joase (50-100°C);
- AlBr3 (bromură de aluminiu) umedă, la temperaturi relativ joase (50-100°C);
- silicați de aluminiu (naturali sau sintetici), denumiți zeoliți, la temperaturi ceva mai ridicate (250-300°C).
Savantul român, C.D. Nenițescu, și-a adus contribuția în Chimie, studiind reacția de izomerizarea a butanului, motiv pentru care această reacție poartă numele său, în semn de apreciere pentru studiul acestui echilibru de reacție.
Reacția de izomerizare alcan – izoalcan, este reversibilă. Astfel, izomerizarea butanului se desfășoară în ambele sensuri. La finalul procesului rezultă un amestec care conține procentual: 80% izobutan (2-metilpropan) și 20% n-butan.
În industria petrochimică, cea mai importantă aplicație practică a reacțiilor de izomerizare este obținerea benzinelor de calitate superioară, în compoziția cărora intră izoalcani. Aceștia se comportă mai bine la aprindere în motoarele cu explozie, comparativ cu n-alcanii.
Cifra octanică (C.O.) este un indicator de apreciere a calității benzinei. Existența unei scări convenționale ajută la stabilirea valorii cifrei octanice. Cifra octanică este un parametru care caracterizează rezistența la detonație a benzinelor. De exemplu, izooctanul (sau 2,2,4-trimetilpentan) prezintă cifra octanică 100 și este deosebit de rezistent la detonare, față de n-heptan care prezintă cifra octanică 0 și este puternic detonant.
Cifra octanică constituie procentul (%) masic (de masă) de izooctan dintr-un amestec cu n-heptan care prezintă aceeași rezistență de detonație ca benzina examinată.
Reacția de descompunere termică
Temperaturile relativ mari sunt o condiție necesar obligatorie pentru ca reacția de descompunere termică a alcanilor să aibă loc. Rezultă astfel un amestec de alcani și alchene care conțin în molecule un număr mai mic de atomi de carbon (alcani și alchene inferioare).
Temperaturile mai mici de 650°C favorizează descompunerea termică a alcanilor, proces care poartă convențional numele de cracare (din limba engleză, to crack = a sparge). În urma procesului de cracare se scindează (se rup) legături C–C, rezultând un amestec de alcani și alchene inferioare.
Temperaturile mai mari de 650°C favorizează descompunerea termică a alcanilor, proces denumit piroliză (din limba greacă, piros = foc, lisis = scindare). În aceste condiții, pe lângă reacțiile de cracare, au loc reacții de dehidrogenare.
Cu cât dimensiunea moleculei alcanului crește, cu atât descompunerea termică a acestora are loc la temperaturi mai mici (mai joase). De exemplu, metanul este stabil până la o temperatură aproximativă de 900°C, pe când alcanii superiori se descompun la temperaturi mai scăzute (400-600°C), când au loc reacții de cracare și dehidrogenare.
ACTIVITATE EXPERIMENTALĂ
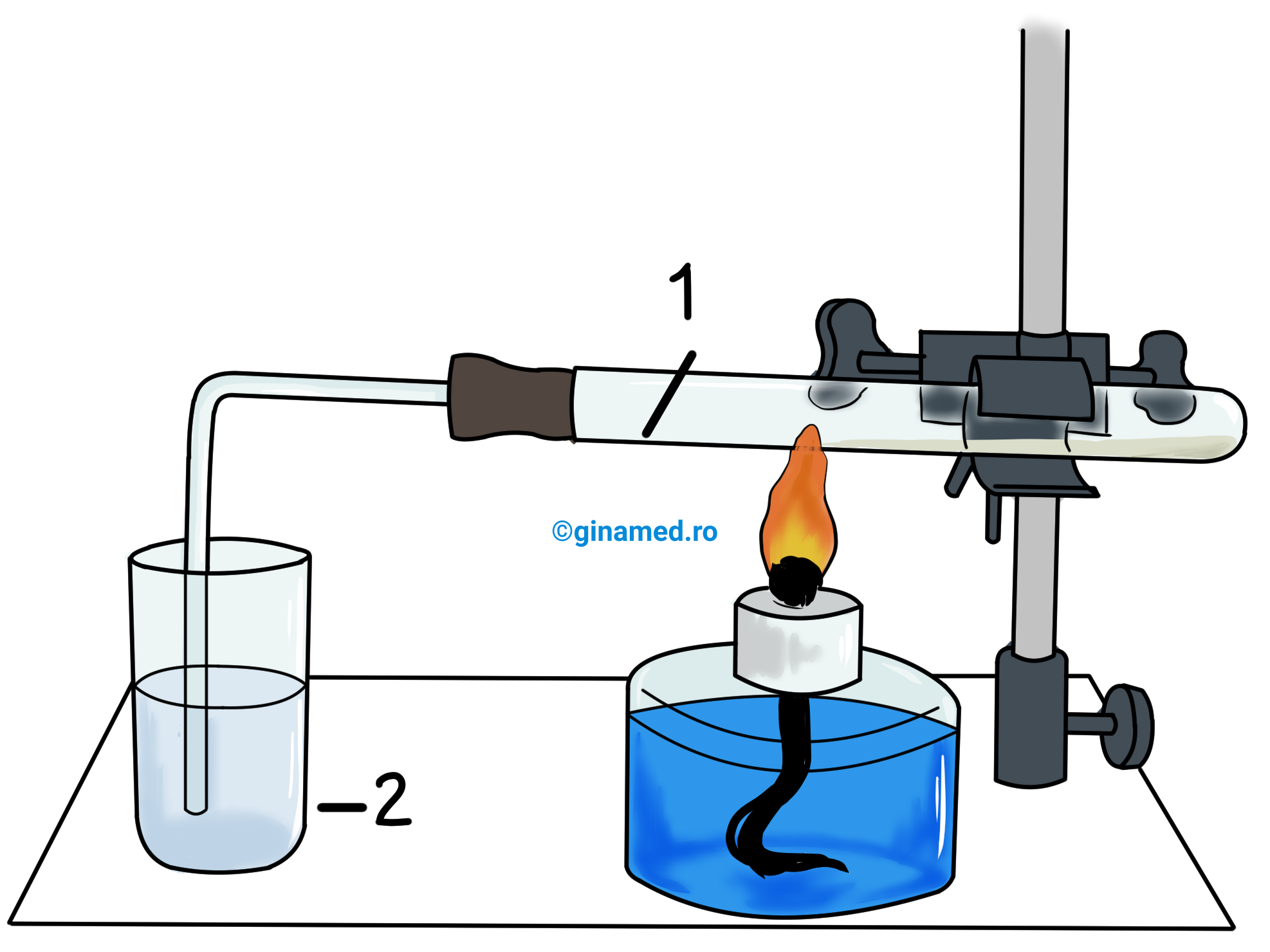
Observații: Prin încălzirea eprubetei se remarcă cum în paharul de sticlă barbotează un gaz care decolorează soluția de brom în tetraclorură de carbon. Încălzirea eprubetei descompune termic alcanii și vor rezulta alchene gazoase (etenă, propenă, 1-butenă, 2-butenă) care decolorează soluția de brom în tetraclorură de carbon.
Astfel, prin descompunerea termică a n-butanului la 600°C au loc următoarele reacții chimice:
- reacții de cracare
- reacții de dehidrogenare
Piroliza metanului
Creșterea temperaturii peste 1200°C determină reacția de piroliză a metanului.
La temperaturi de peste 1200°C se stabilește un echilibru în sens favorabil formării acetilenei, când aceasta este totuși instabilă. Pentru a împiedica descompunerea acetilenei formate, temperatura trebuie să fie rapid scăzută sub 100°C.
Din piroliza metanului rezultă un produs secundar, sub formă de praf foarte fin, și anume carbon elemental, denumit negru de fum.
Reacția de oxidare
În funcție de produșii de oxidare rezultați din reacție, oxidarea compușilor organici, poate fi:
- Oxidare completă (denumită, în general, ardere) – reacție în urma căreia rezultă CO2 și H2O indiferent de natura compușilor organici. Totodată, în urma reacției se degajă o cantitate mare de energie sub formă de căldură și lumină.
- Oxidare incompletă sau parțială (denumită, în general, oxidare) – reacție în urma căreia rezultă compuși organici care conțin grupe funcționale cu oxigen. În funcție de agenții de oxidare utilizați și de condițiile de reacție, oxidarea poate fi blândă sau energică.
Arderea alcanilor
Faptul că în urma reacției de ardere în aer a alcanilor se degajă o cantitate mare de căldură, favorizează utilizarea acestora ca și combustibili:
- gazul metan – pentru încălzirea locuințelor;
- aragazul (amestec de propan și butan);
- butanul – pentru încălzirea locuințelor;
- gazul natural și aragazul – pentru pregătirea hranei;
- benzinele – pentru a pune în mișcare vehicule care dispun de motoare cu combustie internă (automobil, avion)
Alte întrebuințări ale reacției de ardere a alcanilor:
- flăcările lumânărilor și opaițelor utilizate pentru iluminatul încăperilor, au fost înlocuite cu lămpile cu gaz lampant, înainte de descoperirea curentului electric;
- la începutul secolului trecut, a fost folosit gazul metan pentru iluminatul public; Bucureștiul fiind printre primele orașe din lume iluminate stradal cu felinare stradale cu gaz.
În general, arderea nu are loc spontan. Combustibilul trebuie să fie mai întâi încălzit – de exemplu, se aprinde cu flacăra unui chibrit sau cu o scânteie electrică.
Căldura de ardere
Q – sau căldura de ardere, constituie căldura degajată la arderea unui mol de substanță. Aceasta se măsoară în kJ sau kcal. (1 cal = 4,18 J)
Puterea calorică a combustibililor diferă și poate crește în următorul sens: lemn < cărbune brun < antracit < cocs < gaz natural < benzină.
Problemă rezolvată
Rezolvare:
n – numărul de moli
44,64 moli .............. x kcal
Oxidarea incompletă (oxidare)
Se cunoaște faptul că în reacțiile de oxido-reducere numărul de oxidare (N.O.) al unor elemente din compușii care reacționează se modifică astfel:
- numărul de oxidare al elementului chimic crește în reacțiile de oxidare;
- numărul de oxidare al elementului chimic scade în reacțiile de reducere.
Același lucru este valabil și pentru reacțiile de oxidare și reducere în care sunt implicați compuși organici. Variația conținutului de oxigen sau de hidrogen al compușilor organici este un criteriu practic, utilizat în chimia organică cu scopul de a sistematiza reacțiile de oxido-reducere care au loc.
Reacțiile de oxidare se consideră a fi reacțiile care conduc la:
- creșterea conținutului în oxigen a unei molecule;
- creșterea numărului de legături chimice prin care oxigenul se leagă de carbon;
- scăderea conținutului de hidrogen al moleculei.
Conform acestui criteriu, creșterea gradului de oxidare al compusului organic, precum și creșterea numărului de oxidare al atomului de carbon are loc în sensul:
Cu alte cuvinte, gradul de oxidare al compusului organic variază direct proporțional cu numărul de oxidare al atomului de carbon.
La acțiunea agenților oxidanți, alcanii rămân stabili. În prezența unor catalizatori, alcanii superiori (parafina) se oxidează (cu sau fără ruperea moleculei), rezultând acizi carboxilici superiori (cu număr mare de atomi de carbon, acizi grași) folosiți la fabricarea săpunurilor.
Chimizarea metanului prin oxidare
Metanul, este un component major al atmosferei planetelor Jupiter, Neptun, Saturn și Uranus. Metanul este un gaz ce a fost detectat și în spațiul interstelar.
Metanul a fost descoperit de Volta în anul 1770 și denumit de acesta – gaz de baltă. În natură, metanul se formează ca urmare a acțiunii anaerobe a unor bacterii asupra resturilor animale și vegetale de pe fundul lacurilor. Acest proces natural de putrezire este utilizat în prezent, în mod controlat, cu scopul de a descompune deșeurile organice din apele reziduale ale orașelor mari, în compuși netoxici.
Metanul constituie componentul principal din gazele naturale. În România, zăcămintele de gaz metan prezintă puritate crescută (98-99%). De exemplu, zăcământul de la Sărmășel conține 99,18% gaz metan.
Din gazele de sondă fac parte:
- metan;
- etan;
- propan;
- n-butan;
- izo-butan.
Metanul face parte și din gazul de cocserie în proporție de 25%. În minele de cărbuni se întâlnește și metanul. O concentrație mare de metan poate forma împreună cu aerul un amestec exploziv, care poartă numele de gaz grizu.
Totodată, cantități mari de metan sunt folosite ca și combustibil gazos cu putere calorică mare.
Prin executarea unor reacții chimice în care este implicat metanul, rezultă substanțe cu importanță practică. În condiții diferite de lucru, reacțiile de oxidare blândă a metanului, reprezintă o direcție de chimizare a metanului.
ACTIVITATE EXPERIMENTALĂ
Mod de lucru: Se prinde un bec de gaz și se reglează admisia de aer, astfel încât flacăra să fie colorată în galben, ceea ce justifică o ardere incompletă a gazului metan. Cu ajutorul unui clește de metal se ține deasupra flăcării o placă albă de faianță sau un pahar cu gura în jos.
Observații: Placa de faianță se acoperă de un strat subțire de cărbune, iar pe peretele și pe fundul paharului apar picături de apă.
Astfel, ca urmare a arderii metanului în aer, în atmosferă săracă în oxigen, rezultă carbon fin divizat (negru de fum) și apă:
Negrul de fum este utilizat la:
- fabricarea vopselelor;
- fabricarea anvelopelor de automobile.
În urma arderii incomplete a metanului rezultă gazul de sinteză (amestec de monoxid de carbon și hidrogen, în raport molar 1:2):
Gazul de sinteză este utilizat pentru sinteza de alcani superiori și alcool metilic (metanol). Hidrogenul poate fi utilizat pentru sinteza amoniacului și alte scopuri.
Metanul trecut împreună cu vapori de apă peste un catalizator de nichel (Ni) la aproximativ 800°C suferă o reacție de oxidare incompletă, rezultând un amestec de monoxid de carbon (CO) și hidrogen, în raport molar 1:3 (amestec denumit gaz de apă):
Un amestec de metan și oxigen se încălzește la 400°C, sub o presiune de 60 atm și se formează alcool metilic (metanol):
În urma încălzirii metanului la 400-600°C, însă în prezența catalizatorilor oxizi de azot, metanul se oxidează la metanal (aldehidă formică):
Acidul cianhidric (HCN) este folosit în mod special în industria polimerilor, pentru obținerea fibrelor sintetice. La fabricarea HCN se folosește metan. Prin reacția de oxidare a metanului în prezență de amoniac (reacție de amonoxidare), care are loc la temperaturi ridicate de 1000°C și platina (Pt) drept catalizator, rezultă acid cianhidric.
Deci, chimizarea metanului presupune procese de oxidare (cu obținere de gaz de sinteză, metanol, metanal, acid cianhidric, gaz de apă) și de piroliză cu obținere de acetilenă.
3.8. Acțiunea alcanilor asupra mediului și asupra oamenilor
Alcanii sunt compuși organici nepolari care practic nu se solubilizează în apă, însă pot fi solvenți buni pentru alte substanțe organice cu molecule nepolare. Cunoscând aceste proprietăți, se recurge la utilizarea alcanilor ca materii prime sau auxiliare în fabricarea de produse necesare, dar totodată și evaluarea și diminuarea riscurilor în caz de dezastre ecologice.
Alcanii superiori în stare solidă – vaselina sau parafina, care prezintă un grad crescut de puritate, sunt folosite ca substanțe auxiliare în obținerea de produse farmaceutice sau cosmetice sub formă de cremă. Efectul emolient al vaselinei intervine în menținerea umidității pielii.
Un bun solvent pentru grăsimi este benzina. La contactul direct al acesteia cu pielea sau prin inhalarea vaporilor, benzina dizolvă grăsimile din alcătuirea membranelor celulelor și favorizează declanșarea unor efecte fiziologice grave, cum ar fi:
- iritații;
- inflamații;
- arsuri chimice.
Astfel, este recomandată utilizarea de mănuși de cauciuc chiar și atunci când se efectuează alimentarea cu benzină a autovehiculelor – aspect pus la dispoziție clienților în stațiile de benzină.
În cazul în care există vopsea pe suprafața mâinilor, aceasta nu va fi îndepărtată cu ajutorul benzinei. În acest caz se recurge la diluanți speciali care să nu afecteze membrana celulelor. În cazul în care sunt utilizate materiale textile îmbibate cu benzină pentru curățarea vopselei de pe anumite suprafețe murdare, atunci se recomandă folosirea mănușilor de cauciuc.
Dezastre ecologice în apele mărilor, oceanelor și în apele curgătoare pot fi cauzate de deversările de petrol sau benzină. Acestea plutesc la suprafața apei, formând o peliculă care blochează schimbul de oxigen între apă și aer, favorizând moartea faunei și a vegetației subacvatice. O situație similară se întâlnește și în cazul deversărilor la suprafața solului. Aceste substanțe vor pătrunde în pământ și vor bloca circulația normală a aerului și a apei, distrugând structura chimică și fizică a pământului cu efecte dramatice asupra echilibrului ecosistemelor.
Multiplele aplicații practice ale metanului, cuprind:
- combustibil;
- obținerea negrului de fum care poate fi folosit mai departe pentru obținerea de cerneluri, vopsele, în prelucrarea cauciucului;
- obținerea gazului de sinteză;
- obținerea de metanol;
- obținerea acetilenei care mai departe poate fi folosită în obținerea de fibre sintetice;
- obținerea acidului cianhidric care mai departe poate fi folosit în obținerea de fibre sintetice;
- obținerea de derivați halogenați care pot fi folosiți pentru obținerea de solvenți, agenți frigorifici, narcotice;
- obținerea hidrogenului utilizat pentru obținerea de amoniac.
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

