7. Arene
Cuprins:
7.1. Scurt istoric7.2. Structura benzenului
7.3. Structura reală a benzenului
7.4. Clasificarea hidrocarburilor aromatice
7.5. Proprietăți chimice
7.6. Aplicații practice ale unor hidrocarburi aromatice
7.1. Scurt istoric
Cel mai simplu compus din clasa arenelor este benzenul. Acesta a fost izolat în anul 1825 de către Michael Faraday (1791-1867), din gazul degajat ca urmare a arderii seului de balenă. Acest proces ajuta în acea perioadă la iluminat.
3 ani mai târziu, în anul 1837, Laurent, a propus ca acest compus sintetizat să se numească fen, (de la termenul pheno, care înseamnă „care poartă lumină”) ca un omagiu adus lui Faraday. Însă această denumire a rămas doar pentru radicalul fenil. Acesta se obține formal prin îndepărtarea unui atom de hidrogen din molecula benzenului.
Anul 1882 a fost cel în care Armstrong a impus numele benzen, adoptat la nivel internațional și utilizat până în prezent.
Omologul benzenului, toluenul, a fost izolat din balsamul de Tolu, extras din plante din America de Sud.
Arenele sunt compuși care prezintă un miros aromat, motiv pentru care mai sunt denumite și hidrocarburi aromatice.
Arenele sau hidrocarburile aromatice sunt hidrocarburi care prezintă unul sau mai multe cicluri benzenice în moleculă.
7.2. Structura benzenului
În anul 1865 a fost propusă prima formulă structurală monociclică a benzenului de către F. A. Kekulé (Friederich August Kekulé von Stradonitz, 1829-1896), care îi poartă și numele.
Reprezentarea benzenului făcută de către Kekulé a fost sub forma unui ciclu hexagonal regulat alcătuit din 6 atomi de carbon dispuși în vârfurile hexagonului și legați între ei prin intermediul a 3 legături conjugate, repartizate sistemic. Fiecare atom de carbon este legat la rândul său și de un alt atom de hidrogen.
Proprietăți care confirmă structura Kekulé a benzenului
Aceste proprietăți care confirmă structura Kekulé a benzenului, sunt:
Proprietăți care sunt în contradicție cu structura Kekulé a benzenului
Aceste proprietăți care sunt în contradicție cu structura Kekulé a benzenului, sunt:
1. Conform formulei lui Kekulé, benzenul prezintă 5 izomeri disubstituiți. Însă în realitate benzenul prezinta doar 3 derivați disubstituiți.
2. Conform formulei lui Kekulé, cele 3 legături duble din molecula benzenului ar trebui să imprime acestuia un puternic caracter nesaturat și să dea toate reacțiile specifice alchenelor. Însă în realitate, benzenul prezintă un comportament de hidrocarbură cu caracter saturat, deoarece:
- participă cu ușurință la reacții de substituție;
- nu se oxidează cu KMnO4
- nu reacționează cu apa de brom;
- nu polimerizează.
Într-un număr redus de reacții manifestă un caracter slab nesaturat, implicându-se în reacții de adiție, doar în condiții energice.
3. Conform formulei lui Kekulé, ciclul benzenic ar trebui să prezinte 3 legături simple C-C cu lungimea de 1,54 Å și alte 3 legături duble C=C cu lungimea de 1,33 Å. Însă studierea benzenului prin metoda difracției razelor X a demonstrat că distanțele între 2 atomi de carbon vecini sunt egale și măsoară 1,39 Å. Această valoare este intermediară între lungimile legăturilor C-C și C=C, și se întâlnește și în moleculele omologilor sau derivaților benzenului.
Deci, lungimea legăturii dintre 2 atomi de carbon scade în ordinea: alcani > arene > alchene.
7.3. Structura reală a benzenului
Pentru a înțelege mai bine, sunt necesare cunoștințele de la Alchene unde se explică despre formarea dublei legături.
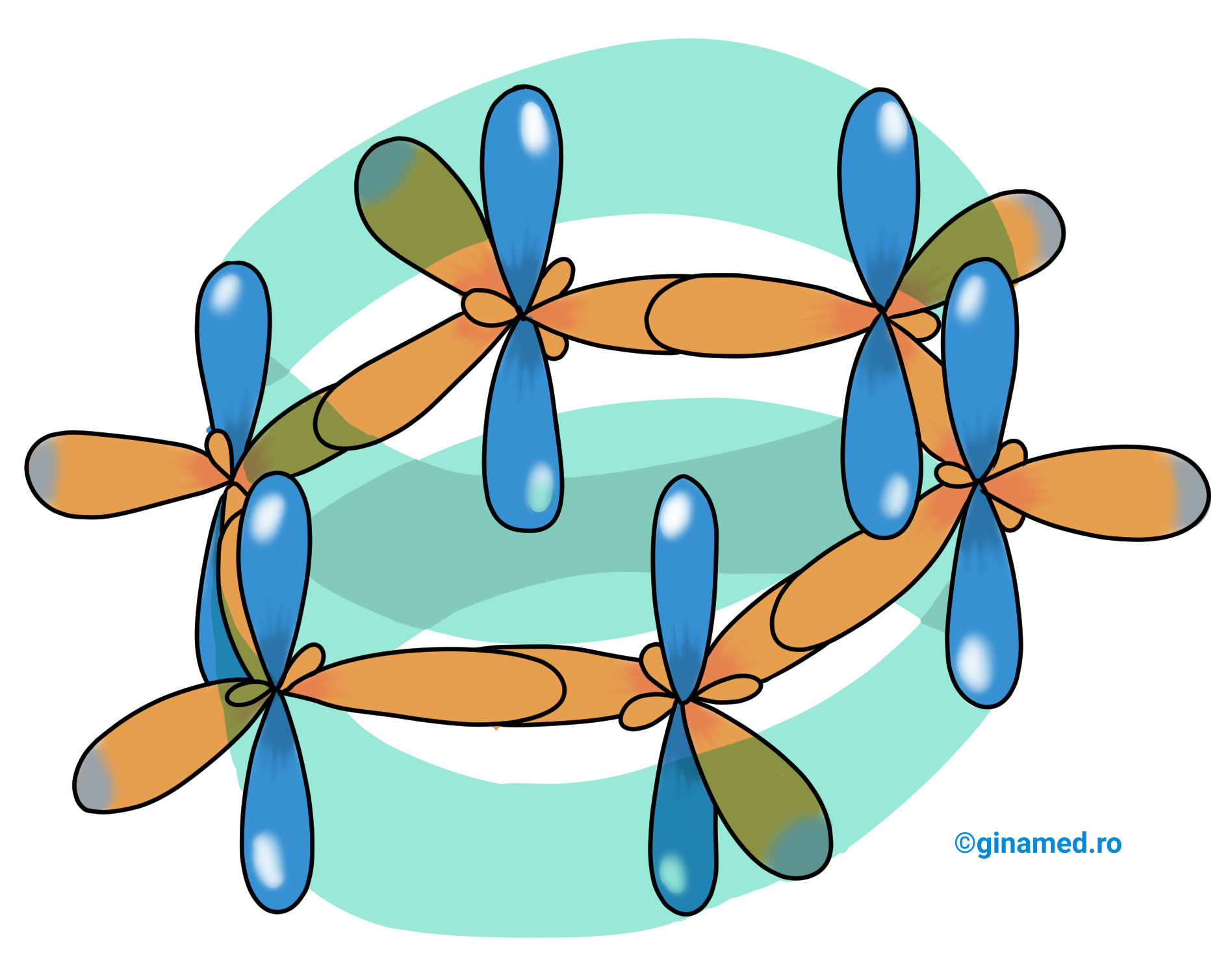
Fiecare atom de carbon din acest ciclu mai dispune de câte un orbital 2p perpendicular pe planul ciclului. Acești orbitali formează un sistem de legături π. Electronii care participă la legătura π nu se află între 2 atomi de C. Acești electroni sunt delocalizați și formează „un nor” de electroni situat de ambele părți ale planului legăturilor σ.
Structura reală a benzenului a fost determinată prin:
- metode de analiză structurală care utilizează raze X;
- spectre în domeniul IR (infraroșu);
- alte metode fizice de cercetare.
S-a stabilit că benzenul prezintă o structură simetrică sub formă de hexagon regulat și plan, cu laturi egale și cu valori ale unghiurilor de 120°. Lungimea legăturilor C-C din benzen este de 1,39 Å și a legăturilor C-H este de 1,09 Å.
Legăturile dintre atomii de carbon sunt echivalente deoarece electronii π nu sunt localizați între anumiți atomi de carbon. Electronii sunt delocalizați și distribuiți în mod uniform pe întregul ciclu, pe ambele părți ale acestuia, asemănător unui nor.
Conform acestei structuri a benzenului se justifică stabilitatea chimică a acestuia, motiv pentru care reacțiile de substituție sunt caracteristice acestei molecule și nu cele de adiție, polimerizare și oxidare. Aceste proprietăți chimice țin de caracterul aromatic. Astfel, arenele prezintă caracter aromatic.
7.4. Clasificarea hidrocarburilor aromatice
În funcție de numărul de cicluri (nuclee) benzenice din moleculă, hidrocarburile aromatice (arenele) se clasifică în:
- hidrocarburi aromatice mononucleare, care pot fi cu catenă laterală sau fără catenă laterală;
- hidrocarburi aromatice polinucleare, care pot fi cu nuclee izolare sau condensate.
Hidrocarburi aromatice mononucleare
Aceste tipuri de arene prezintă un singur ciclu benzenic și pot fi:
- fără catenă laterală: benzenul;
- cu catenă laterală: atomi de hidrogen de la atomii de carbon din ciclul benzenic sunt substituiți cu unul sau mai mulți radicali alchil; în acest caz poartă numele de alchilbenzeni sau fenilalcani; radicalul C6H5– se numește fenil.
Exemple de derivați alchil monosubstituiți ai benzenului sau monoalchilbenzeni. Radicalii din catene laterale pot să fie nesaturați – de exemplu vinilbenzen sau stiren:
| Metilbenzen (toluen) | Etilbenzen | n-propilbenzen | Izopropilbenzen (cumen) | Etenilbenzen/vinilbenzen/stiren |
|---|---|---|---|---|
Pentru denumirea hidrocarburilor aromatice se respectă regulile IUPAC. Arenele care prezintă multiple aplicații practice au și denumiri uzuale.
În ceea ce privește derivații disubstituiți ai benzenului, pozițiile substituienților sunt indicate prin cifre sau cu ajutorul prefixelor: orto (o-), meta (m-), para (p-).
Cei 3 derivați dimetilbenzen (xileni):
| orto-xilen | meta-xilen | para-xilen |
|---|---|---|
| 1,2-dimetilbenzen | 1,3-dimetilbenzen | 1,4-dimetilbenzen |
Hidrocarburile aromatice polinucleare
Aceste tipuri de arene polinucleare prezintă două sau mai multe cicluri (nuclee) benzenice care pot fi:
- condensate;
Exemple de hidrocarburi aromatice cu nuclee condensate:
| Naftalen (naftalină) | Antracen | Fenantren |
|---|---|---|
- izolate - de exemplu, difenil.
| Difenil |
|---|
Radicalii care provin de la arene poartă numele de aril (Ar-).
Câteva exemple de radicali monovalenți proveniți de la arene:
| Formulă | Radical | Arenă |
|---|---|---|
| C6H5 – | fenil | benzen |
| C6H5–CH2 – | benzil | toluen |
| C10H7 – | naftil | naftalină |
7.5. Proprietăți chimice
Hidrocarburile aromatice participă la reacții de:
- substituție;
- adiție;
- oxidare.
Aceste reacții pot avea loc atât la nucleul benzenic, cât și la catena laterală.
Reacții la nucleu
Reacții de substituție la nucleu sunt:
- reacția de halogenare;
- reacția de nitrare;
- reacția de sulfonare;
- reacția de alchilare Friedel-Crafts;
- reacția de acilare Friedel-Crafts.
Reacția de substituție este o reacție chimică ce caracterizează substanțele organice care conțin legături simple σ în moleculă. În cadrul unei reacții de substituție, unul sau mai mulți atomi de hidrogen sunt înlocuiți (substituiți) cu unul sau mai mulți atomi sau grupe de atomi.
Reacția de halogenare
Reacția de halogenare a arenelor la nucleu constă în substituția unui atom de hidrogen legat de un atom de carbon din ciclul aromatic, cu un atom de halogen, X. Astfel, rezultă derivați halogenați aromatici: Ar – X, unde X = Cl, Br, I.
Halogenarea benzenului necesită prezența următorilor catalizatori:
- FeCl3, FeBr3 sau AlCl3 pentru Cl2 și Br2;
- HNO3 pentru I2.
Halogenarea naftalinei
În molecula naftalinei sunt 8 grupări –CH– care nu sunt echivalente între ele; pozițiile echivalente, sunt:
- 1, 4, 5, 8 – și se notează cu α;
- 2, 3, 6, 7 – și se notează cu β.
Deci naftalina poate prezenta doar 2 derivați monosubstituiți: α și β. Față de poziția β, poziția α este mai reactivă.
Astfel că, teoretic, în urma halogenării naftalinei pot rezulta 2 derivați monohalogenați diferiți, dependent de poziția atomului la care a avut loc substituția atomului de hidrogen cu un halogen.
Însă în mod practic, compușii rezultați prin halogenarea naftalinei sunt:
| α-cloronaftalină | β-cloronaftalină | 1,2,3,4-tetracloronaftalina |
|---|---|---|
| neizolabil | nu se obține direct | produs final de reacție |
Reacția de nitrare
Nitrobenzenul se caracterizează prin:
- este un compus toxic;
- a fost utilizat la parfumarea săpunurilor sub denumirea de „esență de Mirban”, datorită mirosului său plăcut de migdale amare;
- este utilizat în industria cosmetică datorită mirosului său;
- a fost obținut pentru prima dată de către E. Mitscherlich, în anul 1834;
- este un lichid slab gălbui;
- este insolubil în apă;
- este solubil în alcool sau eter;
- este folosit pentru fabricarea anilinei, în industria coloranților și a medicamentelor.
Prin metode indirecte poate fi obținut și izomerul β-nitronaftalină.
Produșii de nitrare ai compușilor aromatici se folosesc pentru obținerea aminelor aromatice, a intermediarilor în sinteza coloranților, a explozivilor și multe altele.
Reacția de sulfonare
Față de reacția de nitrare, reacția de sulfonare este o reacție reversibilă.
Sulfonarea arenelor necesită:
- acid sulfuric concentrat sau
- oleum (acid sulfuric concentrat care conține SO3).
Reacția de alchilare Friedel-Crafts
Reacția de alchilare este una dintre metodele folosite în sinteza organică prin care se mărește numărul de atomi de carbon din molecula organică.
Reacția de alchilare Friedel-Crafts presupune substituția unui atom de hidrogen de la atomul de carbon din nucleul aromatic cu un radical alchil, obținându-se arene cu catenă laterală.
Alchilarea arenelor se poate realiza cu:
- derivați halogenați, R–X (atomul de halogen să fie legat de un atom de carbon saturat);
- alchene sau
- alcooli, R–OH.
- AlCl3 reacționează cu urmele de apă conducând la HCl, care apoi se adiționează la alchenă; din reacție rezultă și hidroxid de aluminiu precipitat;
- derivatul halogenat rezultat participă la reacția de alchilare a arenei.
Dacă alchena este în exces, se formează într-o proporție mai mare di- și trialchilbenzenii.
Reacția de acilare Friedel-Crafts
- cloruri acide, R–COCl și
- anhidride acide (R–CO)2O.
Formulele generale ale acidului carboxilic și a derivaților săi funcționali: clorură acidă și anhidridă acidă:
| Acid carboxilic | Clorură acidă | Anhidridă acidă |
|---|---|---|
Orientarea substituenților pe nucleul benzenic
Derivații monosubstituiți ai benzenului pot participa și ei la reacții de substituție, iar în acest caz, cel de-al doilea substituent va o ocupa o anumită poziție pe nucleul aromatic, dată de natura primului substituent (preexistent) fixat pe ciclul benzenic.
Substituenții preexistenți (care sunt deja fixați pe nucleul aromatic) pot fi substituenți de ordinul I și substituenți de ordinul II.
Substituenții de ordinul I sunt cei care orientează în pozițiile orto (o-) și para (p-) cel de-al doilea substituent. Sunt substituenți de ordinul I:
- halogenii, –F, –Cl, –Br, –I;
- radicalii alchil, –R (de exemplu, metil –CH3, etil –CH2–CH3, etc.);
- grupa hidroxil, –OH;
- amino, –NH2.
Cu excepția halogenilor, ceilalți substituenți de ordinul I activează nucleul benzenic pe care sunt prezenți, favorizând desfășurarea cu ușurință a reacțiilor de substituție comparativ cu cele în care ar fi implicat nucleul benzenic nesubstituit.
Completare: Substituenții care activează nucleul aromatic au efect respingător de electroni spre nucleul aromatic, activându-l pentru cedare de protoni.
Substituenții de ordinul II sunt cei care orientează în poziția meta (m-) cel de-al doilea substituent. Sunt substituenți de ordinul II:
- grupa nitro, –NO2;
- grupa sulfonică, –SO3H;
- grupa carboxil, –COOH;
- grupa carbonil, ;
- grupa nitril, –CN;
- gruparea –CCl3.
Substituenții de ordinul II dezactivează nucleul benzenic pe care sunt prezenți, îngreunând desfășurarea reacțiilor de substituție comparativ cu nucleul benzenic nesubstituit.
Completare: Substituenții care dezactivează nucleul benzenic au efect atrăgător de electroni
Prin încălzire și lovire, substanțele explozive se descompun, formând un volum mare de compuși în stare gazoasă și cu degajarea unei cantități mari de energie.
Reacții de adiție
Arenele pot da reacții de adiție (hidrogenare, halogenare) doar în condiții energice.
Adiția hidrogenului
În prezența catalizatorilor de nichel (Ni), la 200°C, benzenul adiționează hidrogen și devine o hidrocarbură ciclică saturată, denumită ciclohexan.
Naftalina adiționează hidrogen în două etape, deoarece ciclurile benzenice se hidrogenează pe rând, folosind catalizatori de Ni, Pd, Pt. În prima etapă a procesului de adiție a hidrogenului la naftalină se obține tetrahidronaftalina (tetralina) și apoi decahidronaftalina (decalina).
Tetralina și decalina sunt în stare de agregare lichidă și sunt folosite ca dizolvanți și carburanți.
Naftalina prezintă un caracter aromatic mai slab comparativ cu benzenul, aspect care reiese din participarea cu ușurință a naftalinei la reacții de adiție.
În seria hidrocarburilor aromatice polinucleare cu nuclee condensate, caracterul aromatic variază invers proporțional cu creșterea numărului de nuclee condensate. Deci caracterul aromatic scade în același timp cu creșterea numărului de nuclee condensate.
Adiția halogenilor
Adiția clorului și bromului la benzen are loc în prezența radiațiilor ultraviolete sau a luminii solare sau poate avea loc și termic.
Un izomer la compusului H.C.H. este hexacloranul (gamexanul), utilizat ca insecticid.
Reacții de oxidare
Oxidarea benzenului
Benzenul are o mare stabilitate termică și rezistență foarte mare la acțiunea agenților oxidanți obișnuiți. Benzenul se oxidează doar la temperatură ridicată, în prezență de catalizator, cu ruperea ciclului.
- un izomer cis, denumit acid maleic;
- un izomer trans, denumit acid fumaric; acesta nu rezultă din oxidarea benzenului și nu poate să formeze anhidridă.
Oxidarea naftalinei
Naftalina, având caracter aromatic mai slab comparativ cu benzenul, se oxidează la temperatură mai mică, dar tot cu ruperea unuia dintre cicluri. Mai întâi se formează acid ftalic, care poate pierde o moleculă de apă, trecând în anhidridă ftalică.
Oxidarea antracenului
Reacții la catena laterală
Hidrocarburile aromatice care prezintă și catenă laterală vor participa la reacții chimice caracteristice nucleului aromatic, dar și la reacții care se desfășoară la catena laterală.
Halogenarea în poziția benzilică
Poziția benzilică este poziția vecină nucleului aromatic din catena laterală a hidrocarburilor aromatice.
| Toluen | Radicalul benzil | Poziția benzilică |
|---|---|---|
Clorurarea toluenului în prezența luminii se desfășoară doar la catena laterală, fără a implica nucleul aromatic, conducând la un amestec de derivați halogenați:
- clorură de benzil;
- clorură de benziliden;
- clorură de benzin.
Oxidarea la catena laterală
Oxidarea catenei laterale (alchil) legată de un atom de carbon dintr-un nucleu aromatic, se desfășoară în prezența:
- agenților oxidanți (soluție acidă de KMnO4 sau K2Cr2O7 la cald) sau
- a oxigenului molecular și catalizatori.
ACTIVITATE EXPERIMENTALĂ
În situația în care nucleul aromatic este substituit cu două grupe alchil, fiecare dintre acestea se va oxida.
Dintre toți acizii rezultați prin oxidarea xilenilor (acid ftalic, izoftalic, tereftalic), numai acidul ftalic permite formarea de anhidridă deoarece cele două grupări carboxilice sunt apropiate și favorizează închiderea unui ciclu stabil de 5 atomi.
Indiferent de lungimea catenei laterale, radicalii alchil conținuți de aceasta, sunt oxidați la acizi în care grupa carboxil –COOH este legată direct de atomi de carbon care fac parte din nucleul aromatic.
În cazul în care poziția benzilică a catenei laterale nu prezintă hidrogen atunci oxidarea cu agenți oxidanți nu poate să aibă loc.
Oxidarea catenei laterale a alchilbenzenilor prezintă importanță în anumite procese metabolice. În acest fel, vaporii de toluen sunt cu mult mai puțin toxici comparativ cu cei de benzen.
Toluenul, odată pătruns în organism, în prezența unei enzime hepatice (din ficat) poate fi oxidat la acid benzoic, compus ușor de eliminat prin urină.
Pe de altă parte, benzenul, neavând catenă laterală, nu poate fi oxidat și în prezența aceleiași enzime poate să favorizeze apariția mutațiilor în ADN.
De aici se deduc efectele cancerigene ale benzenului și a altor hidrocarburi aromatice care nu prezintă catenă laterală, față de toluen, care nu este cancerigen.
7.6. Aplicații practice ale unor hidrocarburi aromatice
Benzenul, toluenul și naftalina sunt hidrocarburi aromatice (arene) care prezintă importanță practică propriu-zisă sau prin compușii chimici la care conduc prin procese industriale.
Aplicațiile practice ale benzenului urmăresc utilizarea sa:
- în industria coloranților;
- în industria medicamentelor;
- ca dizolvant;
- pentru obținerea de stiren care este folosit mai departe pentru producția de cauciuc sintetic și mase plastice;
- pentru obținerea de parfumuri;
- pentru obținerea de insecticide;
- pentru obținere de detergenți.
Aplicațiile practice ale toluenului urmăresc utilizarea sa:
- în industria coloranților;
- în industria medicamentelor;
- în industria explozivilor;
- ca diluant.
Aplicațiile practice ale naftalinei urmăresc utilizarea sa:
- în industria coloranților;
- în obținerea de naftoli;
- în sinteza de tetralină și decalină;
- ca insecticid;
- în Medicină;
- pentru obținerea de dizolvanți;
- ca dezinfectant.
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005

