Curs preliminar chimie
Cuprins:
1. Chimie organică vs. chimie anorganică2. Structura atomului
3. Reguli de completare a straturilor cu electroni
4. Tipuri de hibridizări
5. Masa atomică
6. Masa molară
7. Ioni, electrovalență, moleculă
8. Metale vs. nemetale
9. Soluții
10. Oxidare vs. reducere
11. Volum molar
12. Densitate
13. Legea gazelor
14. Reacție chimică
15. Puritate
16. Electroni de valență, covalență
17. Numărul de oxidare
18. Legături chimice
19. Ordinea priorității grupelor funcționale
20. Regula de 3 simplă
21. Regula dreptunghiului
22. Conversia unităților de măsură
1. Chimie organică vs. chimie anorganică
Chimia organică este disciplina care se ocupă cu studiul structurii, proprietățile, reacțiile compușilor organici. Aceștia sunt alcătuiți, în principal, din carbon, hidrogen.
Chimia anorganică este disciplina care se ocupă cu studiul structurii, proprietățile, reacțiile compușilor anorganici. Aceștia sunt metalele, mineralele, compușii organometalici.
2. Structura atomului
Atomul reprezintă cea mai mică particulă de materie care nu mai poate fi divizată prin procedee chimice. Din punct de vedere electric, atomul este o particulă neutră.
În alcătuirea atomului intră particule subatomice:
- electroni;
- protoni;
- neutroni.
Numărul protonilor se notează cu Z și este egal cu numărul de electroni și poartă numele de număr atomic.
Masa unui atom este concentrată practic în nucleu (deoarece electronii sunt de aproximativ 1000 de ori mai ușori decât protonii și neutronii) și se exprimă prin numărul de masă, A (număr întreg).
Numărul de neutroni, N, este dat de diferența dintre numărul de masă, A și numărul atomic, Z.
Totalitatea atomilor cu aceeași sarcină nucleară (este sarcina electrică a nucleului, valoare dată de suma sarcinilor protonilor din nucleu) alcătuiesc un element chimic. Acesta este notat prescurtat printr-un simbol chimic.
Nucleul atomului se compune din: protoni și neutroni. În jurul nucleului se mișcă electronii sub forma unui nor electronic și reprezintă învelișul electronic al atomului.
Învelișul electronic al atomului reprezintă totalitatea electronilor care gravitează în jurul nucleului. Învelișul electronic este stratificat, fiind alcătuit din straturi, substraturi și orbitali.
Porțiunea de spațiu din jurul nucleului unde este probabilitatea maximă de a găsi electronul, poartă numele de orbital atomic.
Atomii polielectronici prezintă diverse forme de orbitali clasificați în 4 categorii principale: s, p, d, f. Acestea se diferențiază prin mărimea norului electronic.
Un orbital s este un nor electronic sferic a cărui densitate scade pe măsură ce distanța față de nucleu crește.
Orbitalii de tip p sunt bilobari, formați din 2 lobi simetrici situați de o parte și de alta a nucleului.
Orbitalii de tip d și f au forme complexe și reprezentarea acestora este dificilă.
Fiecare orbital atomic definește o stare posibilă a electronului în atom și corespunde unui nivel energetic, care depinde de norul electronic față de nucleu și se caracterizează prin energie și geometrie proprie. Mai mulți orbitali de aceeași energie formează un substrat electronic.

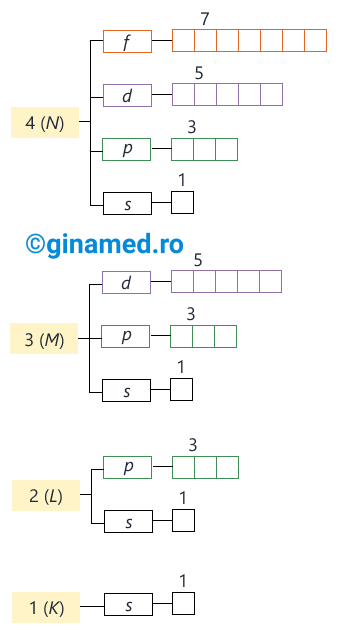

3. Reguli de completare a straturilor cu electroni
Între nucleu și învelișul electronic sunt forțe de atracție care determină electronii să se dispună cât mai aproape de nucleu. Astfel, ocuparea straturilor cu electroni se supune următoarelor principii:
- principiul energetic: în starea fundamentală a unui atom polielectronic, electronii ocupă orbitalii atomici în ordinea creșterii energiei, începând cu orbitalul de cea mai joasă energie.
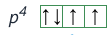
- principiul lui Pauli (de excluziune): un orbital se completează cu maximum 2 electroni cu spin opus.
Spinul electronic definește mișcarea de rotație a electronului în jurul axei sale; mișcarea de spin are simbolul: ↑. 2 electroni pot avea același spin, ↑↑ (paraleli) sau spin opus, ↑↓ (antiparaleli). Conform principiului de excluziune, pentru atomii cu numărul atomic Z > 2, electronii care nu pot ocupa orbitalul 1s, vor ocupa orbitali cu energii mai mari.
- regula lui Hund: starea fundamentală a unui atom este starea în care atomul are un număr maxim de electroni impari (de același spin) în orbitalii cu aceeași energie. În stare fundamentală, electronii ocupă orbitalii cu energie minimă.
Structura electronică a unui atom este redată prin configurația electronică, care reprezintă toți orbitalii ocupați cu electronii pe care îi conține atomul respectiv.
Electronii cu care un atom se angajează în reacții chimice aparțin în general ultimului strat electronic și poartă numele de electroni de valență.
4. Tipuri de hibridizări
Hibridizarea sp3
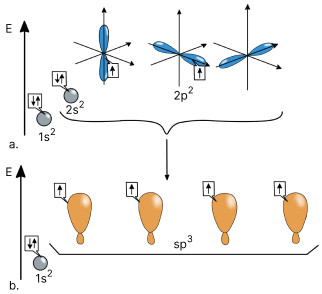
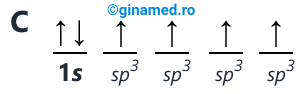
![Schimbarea energiei orbitalilor hibridizați <i>[HTML]sp<sup>3</sup>[/HTML]</i> în starea de valență a atomului de carbon. ](/content/image-upload/schimbarea_energie_hibridizarea_sp3_chimie.png)
Hibridizarea sp2
![a. Starea fundamentală a atomului de carbon; b. Formarea celor 3 orbitali <i>[HTML]sp<sup>2</sup>[/HTML]</i> (E - nivelul de energie).](/content/image-upload/orbitali_sp2_carbon_chimie.png)
![Schimbarea energiei orbitalilor hibridizați <i>[HTML]sp<sup>2</sup>[/HTML] </i>în starea de valență a atomului de carbon. ](/content/image-upload/schimbarea_energie_hibridizarea_sp2_chimie.png)
Hibridizarea sp
În tipul de hibridizare sp, interacționează un orbital s cu un orbital p. Acest tip de hibridizare justifică geometria coaxială (digonală). Energia orbitalilor hibridizați sp este intermediară energiei orbitalilor nehibridizați s și p. Astfel, 2 orbitali p rămân nehibridizați, păstrându-și forma și energia inițială. Acești 2 orbitali p nehibridizați sunt perpendiculari unul pe celălalt și pe planul celor 3 orbitali hibridizați sp.
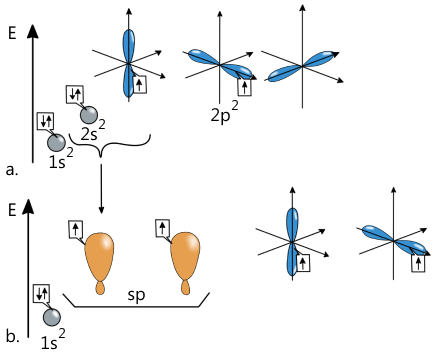
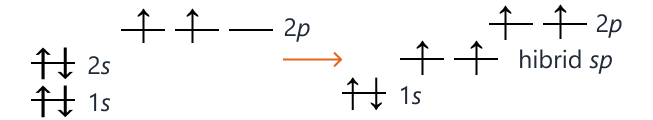
5. Masa atomică
Masa unui atom este concentrată practic în nucleu (deoarece electronii sunt de aproximativ 1000 de ori mai ușori decât protonii și neutronii) și se exprimă prin numărul de masă, A (număr întreg).
Speciile de atomi care prezintă aceeași sarcină nucleară (număr atomic Z), însă prezintă număr de masă diferit, se numesc izotopi.
Unele elemente conțin mai mulți izotopi și astfel, masa atomică a unui element chimic este diferită de numărul de masă al speciei chimice respective. Astfel, masa atomică a unui element se determină ca medie ponderată a maselor tuturor izotopilor stabili identificați pentru elementul respectiv.
Numărul de masă al unui izotop este întotdeauna un număr întreg, însă masa atomică a elementului este un număr fracționar.
Un mol de atomi reprezintă cantitatea în grame dintr-un element, numeric egală cu masa atomică relativă.
6. Masa molară
Calcularea masei molare a unei molecule se face prin însumarea maselor atomice ale elementelor componente.
7. Ioni, electrovalență, moleculă
Particule de materie care provin de la atomi, prin cedare sau acceptare de electroni, poartă numele de ioni. Numărul de electroni cedați sau acceptați redau electrovalența. Deci aceasta poate fi pozitivă sau negativă.
Molecula cumulează un ansamblu de atomi constituit ca o entitate chimică individuală. Molecula este stabilă și neutră din punct de vedere electric.
8. Metale vs. nemetale
Tabelul periodic redă configurațiile electronice ale elementelor, pe baza cărora se pot intui proprietățile lor fizice și chimice. În funcție de tendința acestor elemente de a ajunge la configurația stabilă de octet sau dublet pe ultimul strat electronic, elementele se clasifică în: metale și nemetale.
Metalele sunt bune conductoare de căldură și electricitate și sunt maleabile (proprietate prin care un material poate fi îndoit într-o anumită formă) și ductile (proprietate prin care un material poate fi tras în fire subțiri). Majoritatea metalelor sunt solide la temperatura camerei și prezintă luciu caracteristic (excepția face mercurul care este lichid). Totodată, metalele sunt elemente care în cursul reacțiilor chimice pierd electroni și se transformă în ioni pozitivi (cationi). Din punct de vedere chimic, reacționează cu substanțe simple (oxigen, sulf, halogeni) și substanțe compuse.
Nemetalele sunt în general slabe conductoare de căldură și electricitate și nu sunt maleabile sau ductile. Numeroase nemetale sunt gaze la temperatura camerei, iar altele sunt lichide și unele solide. Totodată, nemetalele sunt elemente care în cursul reacțiilor chimice nu pierd electroni, ci îi acceptă și formează ioni negativi (anioni). Din punct de vedere chimic, reacționează cu substanțe simple (metale, alte nemetale) și substanțe compuse.
9. Soluții
Dizolvarea reprezintă fenomenul în urma căruia o substanță lichidă, solidă sau gazoasă se răspândește printre moleculele altei substanțe cu formare de soluții.
Soluțiile sunt amestecuri omogene formate din două sau mai multe substanțe. Orice soluția se compune din:
- dizolvant (solvent) – substanța în care are loc dizolvarea;
- dizolvat (solut) – substanța care se dizolvă.
Concentrația unei soluții reprezintă masa de substanță dizolvată conținută într-o anumită cantitate de soluție sau solvent.
Concentrația procentuală reprezintă cantitatea de substanță dizolvată în 100 g de soluție (procent de masă).
Concentrația unei soluții poate fi exprimată și sub formă de concentrație molară. Molaritatea (M) unei soluții reprezintă raportul dintre numărul de moli de substanță dizolvată într-un litru de soluție. Unitatea de măsură: mol/L (1 M = 1 mol/L).
Molaritatea se definește în funcție de volumul soluției, NU în funcție de volumul solventului utilizat.
Solubilitatea este proprietatea unei substanțe de a se dizolva într-un anumit solvent.
10. Oxidare vs. reducere
Oxidarea este procesul prin care o particulă cedează electroni. Specia chimică care cedează electroni, se oxidează și poartă numele de agent reducător.
Reducerea este procesul prin care o particulă acceptă electroni. Specia chimică care acceptă electroni, se reduce și poartă numele de agent oxidant.
11. Volum molar
12. Densitate
Volumul unui gaz depinde de temperatură și presiune, deci densitatea unui gaz depinde și ea de aceeași parametri de stare. Presiunea, volumul și temperatura sunt parametri de stare care descriu starea gazului ideal. Prin gaz ideal se înțelege o stare limită a materiei caracterizată prin faptul că volumul propriu al moleculelor este neglijabil față de volumul total ocupat de gaz. Moleculele se consideră punctiforme, în mișcare continuă, dezordonata și nu interacționează între ele.
Masa moleculară a unui gaz se poate determina și în funcție de densitatea relativă (d) a unui gaz în raport cu un alt gaz de referință:
Densitatea relativă este un număr adimensional.
Pentru a putea umple unele flacoane cu un gaz, este necesar să se cunoască densitatea gazului în raport cu aerul, pentru a alege poziția potrivită (corectă) a vasului de umplut. Masa moleculară a aerului este de M = 28,9 g/mol.
13. Legea gazelor
Presiunea atmosferică este presiunea exercitată de gazul atmosferic asupra pământului.
p, V, T – condițiile stării finale la care ajunge gazul.
Pentru n moli de gaz, ecuația legii gazelor devine: pV = nRT
Dacă în ecuație se înlocuiește n = m/M, se poate calcula de aici masa moleculară a unei substanțe gazoase:
14. Reacție chimică
Catalizatorul este o substanță care schimbă viteza unei reacții chimice, fără să participe la reacție și fără să sufere anumite modificări.
Stoechiometria este partea chimiei care se ocupă cu studiul cantitativ al reacțiilor chimice, adică calculul masei, volumului reactanților și produșilor de reacție. Într-o reacție chimică între cantitățile de reactanți și cele de produși de reacție există o relație de proporționalitate.
În partea din stânga se trec reactanții și în partea din dreapta produșii de reacție. Apoi se face bilanțul atomilor, astfel:
- au intrat în reacție 2 atomi de H și au ieșit tot 2 atomi de H;
- au intrat în reacție 2 atomi de O și a ieșit doar un atom; deci trebuie egalizat numărul atomilor de oxigen, punând 2 în fața formulei apei;
Atunci când se cere aflarea unor mase de pe reacție, să nu se omită înmulțirea masei molare sau a numărului de moli cu coeficientul respectiv din fața substanței.
Un reactant aflat în exces este o substanță care nu a fost consumată sau reacționată în întregime după ce a avut loc o reacție chimică.
Precipitarea este procesul prin care se formează o substanță solidă insolubilă (precipitat) într-un mediu lichid de reacție chimică.
15. Puritate
Substanță pură prezintă o compoziție bine determinată, caracterizată prin constante fizice specifice și care își păstrează compoziția în urma unor fenomene fizice (nu conține alte particule în compoziția sa).
Substanță impură nu prezintă o compoziție bine determinată, în compoziția sa intrând și alte substanțe (impurități).
Puritatea (%) reprezintă cantitatea de substanță pură cuprinsă în 100 g de substanță impură.
16. Electroni de valență, covalență
Proprietățile chimice ale elementelor depind de structura ultimului strat electronic, de tendința elementelor de a realiza pe ultimul strat o configurație stabilă de gaz rar (dublet sau octet). Electronii de pe ultimul strat se numesc electroni de valență (ei determină capacitatea de combinare a atomilor).
Valența elementelor care-și completează ultimul strat electronic prin transfer de electroni, se exprimă printr-o sarcină electrică, egală numeric cu numărul electronilor cedați sau acceptați și poartă numele de electrovalență.
Valența elementelor exprimată prin numărul de electroni pe care atomul unui element îi pune în comun cu electronii altui atom, poartă numele de covalență.
Electronegativitatea este o mărime relativă care exprimă capacitatea unui atom, care face parte dintr-un compus, de a atrage electronii de legătură.
17. Numărul de oxidare
O alternativă la noțiunea de valență, este numărul de oxidare (N.O.). Acesta redă numărul de electroni (cedați sau acceptați) implicați în formarea legăturii chimice.
Numărul de oxidare arată starea de oxidare a unui element într-un anumit compus chimic. Atunci când numărul de oxidare este pozitiv, "+", este indicat faptul că electronii sunt cedați sau sunt puși în comun și deplasați către un atom mai electronegativ. Atunci când numărul de oxidare este negativ, "-", este indicat faptul că electronii sunt acceptați sau sunt puși în comun și deplasați către un atom mai electropozitiv.
În compuși, unele elemente au valori constante, altele prezintă diferite stări de oxidare:
| Element | N.O. în compuși |
|---|---|
| H | +1 |
| O | -2 |
| F | -1 |
| Na | +1 |
| Fe | 2+; +3 |
| Cu | +1; +2 |
| N | -3; 0; +1; +2; +3; +4; +5 |
| S | -2; 0; +4; +6 |
18. Legături chimice
Forțele care apar între atomii unei combinații chimice poartă numele de legături chimice.
Sunt 3 legături chimice:
- legătura ionică;
- legătura covalentă;
- legătura metalică.
Proprietățile substanțelor sunt influențate într-un procent crescut de modul în care sunt legate între ele particulele componente. Ionii cu sarcini electrice opuse se trag, iar aceste forțe sunt de natură electrostatică. Astfel, legătura ionică se stabilește între elemente cu caracter electrochimic diferit (metalul cu un caracter electronegativ mic și nemetalul cu un caracter electronegativ mare). Legătura ionică se realizează prin transfer de electroni de la metal la nemetal astfel încât să stabilească configurație stabilă de octet. Prin transferul de electroni rezultă ioni negativi sau pozitivi care se atrag prin forțe de natură electrostatică. Legătura ionică este o legatură puternică, de aceea substanțele ionice sunt solide.
Legătura covalentă se formează între nemetale sau între elemente cu electronegativități apropiate. Legătura covalentă între 2 atomi (care pot fi identici sau diferiți) se formează prin punere în comun de electroni, care astfel își formează pe ultimul strat configurație stabilă de octet sau dublet. Legătura covalentă este o legătură puternică, dar mai slabă, comparativ cu cea ionică.
Pentru moleculele formate din același tip de atomi, cele două nuclee ale atomilor care formează molecula, prezintă aceeași sarcină pozitivă și electronii de legătură aparțin în egală măsură celor 2 atomi.
Însă în cazul moleculelor formate din atomi diferiți, perechea de electroni pusă în comun este mai puternic atrasă de elementul cu electronegativitate mai mare. De exemplu, molecula de acid clorhidric, HCl, se compune din atomul de hidrogen (H) care prezintă în nucleul un proton (sarcina +1) și atomul de clor (Cl) care prezintă în nucleu 17 protoni (sarcina +17). În acest fel, electronii puși în comun sunt mai puternic atrași de atomul de clor (Cl), acesta având o sarcină pozitivă mai mare.
Deplasarea densității electronice a orbitalului molecular în funcție de caracterul electrochimic al atomilor participanți la formarea unei legături într-o moleculă, poartă numele de polaritate.
În molecula de HCl, deplasarea electronilor de legătură spre atomul de clor, creează un pol electric negativ. Atomul de hidrogen, parțial dezgolit de electroni, reprezintă polul electric pozitiv.
Moleculele polare sunt formate de atomi care au afinitate diferită pentru electronii de valență (atomi de nemetale diferiți). Legătura covalentă în care electronii puși în comun sunt atrași mai puternic spre unul dintre atomi, se numește legătură covalentă polară. Practic, perechea de electroni pusă în comun este atrasă mai puternic de atomul cu electronegativitate mai mare. Polaritatea legăturii este mai mare atunci când diferența de electronegativitate este mai mare. Deci pentru a putea aprecia polaritatea unei legături covalente este necesar să se cunoască seria electronegativității nemetalelor.
Legătura covalentă în care electronii de legătură sunt atrași în mod egal de atomii între care se formează, se numește legătură covalentă nepolară. În general, legătura nepolară se stabilește între nemetale identice.
Moleculele polare sunt moleculele la care centru sarcinilor pozitive nu coincide cu centru sarcinilor negative.
Moleculele nepolare sunt molecule la care centrul sarcinilor pozitive coincide cu centrul sarcinilor negative.
![<b>Unele molecule formate din atomi diferiți sunt molecule nepolare datorită simetriei acestora</b>. În acest fel, polaritatea moleculelor: [HTML]CO<sub>2</sub>, CH<sub>4</sub>, CCl<sub>4</sub>[/HTML] se anulează datorită simetriei.](/content/image-upload/molecule_nepolare_chimie.png)
Interacțiile Van de Waals dipol-dipol sunt caracteristice moleculelor polare. Sarcinile parțiale ale moleculelor polare pot interacționa cu sarcinile parțiale ale unor molecule învecinate, dând naștere legăturilor dipol-dipol. Intensitatea interacțiilor dipol-dipol depinde de polaritatea și forma moleculei.
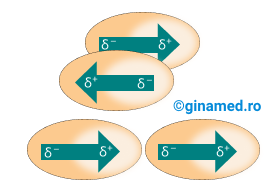
Interacțiile Van de Waals de dispersie se pot stabili între toate tipurile de molecule și sunt mai slabe comparativ cu interacțiile Van de Waals dipol-dipol.
Legăturile de hidrogen sunt interacții intermoleculare de natură fizică care se stabilesc între molecule care conțin atomi de hidrogen legați de un element puternic electronegativ cu volum mic (F, O, N).
Tăria legăturilor scade în ordinea: legătură ionică > legătura covalentă > legătura de hidrogen > interacțiile Van der Waals dipol-dipol > interacțiile Van der Waals de dispersie.
19. Ordinea priorității grupelor funcționale
Într-un compus chimic, prioritatea grupelor funcționale scade în ordinea:
| Clasa de compuși | Structura generală |
|---|---|
| Acizi carboxilici | |
| Anhidride acide | |
| Esteri | |
| Halogenuri acide | |
| Amide | |
| Nitrili | |
| Aldehide | |
| Cetone | |
| Alcooli | |
| Amine | |
| Eteri | |
| Alchene | |
| Alchine | |
| Compuși halogenați (alchil) | |
| Nitroderivați | |
| Alcani |
20. Regula de 3 simplă
Regula de 3 simplă este o metodă de calcul matematic pentru determinarea proporționalității directe și inverse.
Atunci când avem proporții directe, regula de 3 simplă se aplică astfel: presupunem că știm 3 valori: a, b, c și trebuie să află o a patra valoare, x. Apoi notăm astfel:
a ........ b
c ........ x
21. Regula dreptunghiului
Regula dreptunghiului (regula amestecurilor de soluții) se aplică pentru prepararea unei soluții finale de concentrație cunoscută, atunci când se cunosc concentrațiile soluțiilor care se amestecă.
Exemplu: Să se prepare 500 mL soluție HCl 0,5M dintr-o soluție de HCl 0,1M și o soluție HCl 1 M.
Pași pentru rezolvare:
- se desenează un dreptunghi;
- în colțurile din stânga ale dreptunghiului se notează concentrațiile soluțiilor inițiale;
- la intersecția diagonalelor se notează concentrația finală;
- se face diferența concentrațiilor pe diagonală (din concentrația mai mare se scade concentrația mai mică, valoarea să fie întotdeauna pozitivă);
- în colțurile din dreapta ale dreptunghiului se notează părțile obținute din soluțiile care trebuie amestecate, citite pe latura mare a dreptunghiului.
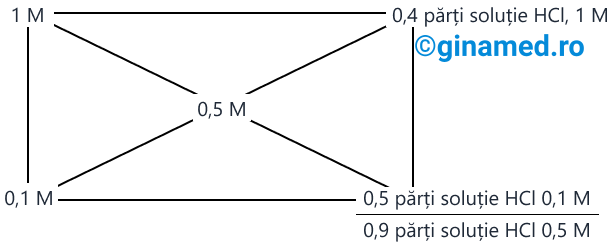
Prin însumare, se obțin 0,9 părți soluție HCl de concentrație finală, 0,5 M. Totalul de 0,9 părți HCl corespunde pentru 0,5 L soluție finală.
0,9 părți ....... 0,5 L soluție
1 parte ......... x L
x = 0,555 L
22. Conversia unităților de măsură
Unitatea de măsură este o proprietate standard care descrie o cantitate fizică.
| Masa unui gram | Volumul unui litru | Volumul unui metru cub | Densitate | Mol |
|---|---|---|---|---|
| 1 g (gram) | 1 L (litru) | 1 m3 | 1 kg/m3 | 1 mol |
| 10 dg (decigrame) | 10 dL (decilitru) | 103 dm3 (decimetru cub) | 1 g/L | 1 ∙ 103 mmol (milimol) |
| 100 cg (centigrame) | 100 cL (centilitru) | 106 cm3 (centimetru cub) | 1 ∙ 10-3 g/cm3 | 1 ∙ 106 μmol (micromol) |
| 1000 mg (miligrame) | 1000 mL (mililitru) | 109 mm3 (milimetru cub) | 1 ∙ 10-3 g/mL | 1 ∙ 10-3 kmol (kilomoli) |
| 1 ∙ 10-3 kg (kilograme) | 1 dm3 (decimetru cub) | 103 L (litru) | ||
| 1 ∙ 10-6 t (tone) |
Bibliografie:
- Chimie - manual pentru clasa a IX-a; Autori: Sanda Fătu, Cornelia Grecescu Veronica David. Editura BIC ALL, București, 2005
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005

