1. Introducere în studiul chimiei organice
Cuprins:
1.1. Istoric1.2. Legături chimice
1.3. Structura compușilor organici
1.4. Analiza elementală a unei substanțe organice
1.5. Determinarea formulei brute
1.6. Determinarea formulei moleculare
1.7. Determinarea formulei structurale
1.8. Clasificarea compușilor organici
1.9. Despre legătura chimică
1.10. Reacțiile compușilor organici
1.1. Istoric
În evoluția speciei umane se regăsesc unele dintre primele informații care fac justifică interesul față de chimia organică. Aceste repere sunt:
- însemnări legate de atelierele de tăbăcit pielea și de obținere a berii, care pot fi remarcate pe o frescă din piramidă din Egiptul antic;
- utilizarea anumitor produse de origine minerală, vegetală și animală, încă de acum 5000 de ani (aspecte incluse în prima farmacopee chineză);
- utilizarea purpurii extrase din moluște marine (de exemplu, melcul de purpură) pentru vopsirea pânzei și a stofelor, de către fenicieni.
Primele clasificări ale substanțelor au fost realizate la finalul secolului al XVIII-lea în:
- substanțe organice – cele de proveniență vegetală și animală; au fost denumite substanțe organice datorită asocierii cu faptul că sunt produse de organisme vii;
- substanțe minerale (anorganice), fără viață – cele care provin din regnul mineral.
Reacțiile de obținere a ureei:
Chimia organică este definită ca fiind chimia hidrocarburilor (compuși în alcătuirea cărora intră doar carbon și hidrogen) și a derivaților acestora.
În România, apariția și dezvoltarea chimiei organice este corelată cu lucrările cercetătorilor:
- Petru Poni (1841-1925), lucrări care privesc studiul petrolului românesc;
- Constatin Istrati (1850-1918), alături de L. Edeleanu, care au documentat chimia compușilor organici;
- Constantin D. Nenițescu (1902-1970), fondatorul Școlii românești de Chimie organică; totodată a contribuit semnificativ în domeniul diferitelor substanțe, cum ar fi: hidrocarburi, compuși heterociclici, compuși naturali; de asemenea, a contribuit și la deslușirea unor mecanisme de reacție.
Obiectul chimiei organice cuprinde:
- sinteza de compuși organici;
- stabilirea (identificarea) structurii acestor compuși;
- studierea proprietăților fizice și chimice ale compușilor sintetizați;
- elucidarea (identificarea) mecanismelor prin care au loc reacțiile chimice în care sunt implicați compuși organici;
Pe lângă atomi de carbon și hidrogen, care sunt elementele principale din molecula compușilor organici, în alcătuirea acestora mai pot intra și atomi de:
- oxigen, O;
- azot, N;
- halogeni: F, Cl, Br, I;
- Sulf, S;
- Fosfor, P;
- în anumite situații, atomi și ioni metalici.
Totalitatea elementelor care intră în alcătuirea compușilor organici se numesc elemente organogene.
1.2. Legături chimice
Catene de atomi de carbon
Orice compus organic conține cel puțin un atom de carbon. Atomul de carbon este tetravalent, aspect stabilit de către Kekulé (în anul 1858), ceea ce indică faptul că are valența 4 în toți compușii săi și formează legături covalente (simple, duble, triple). Excepție face monoxidul de carbon, CO, în care atomul de carbon nu are valența 4.
Cu ajutorul simbolurilor Lewis poate fi scrisă structura electronică a carbonului, unde fiecare punct reprezintă un electron de valență.
Cu scopul de a-și stabili configurația stabilă de octet, se consideră că un atom de carbon pune în comun cei 4 electroni de valență ai săi cu electroni din ultimul strat ai altor atomi de carbon sau ai altor elemente. În acest fel rezultă perechi de electroni care aparțin ambilor atomi și între care se stabilesc legături covalente.
Tot în anul 1858, Couper a demonstrat că atomii de carbon se pot lega unii cu alții asemănător zalelor unui lanț. În acest fel formează „lanțuri de atomi de carbon”, denumite catene. În scrierea formulelor catenelor de atomi de carbon, liniuța aflată între simbolurile atomilor de carbon reprezintă valența.
Exemple:
- un atom de carbon își pune în comun cei 4 electroni de valență cu câte un electron de la 4 atomi de hidrogen (H); în acest fel carbonul își stabilește configurația stabilă de octet (octetul), iar hidrogenul își stabilește configurația stabilă de dublet, cum se observă în figura de mai jos; astfel de obține molecula de metan: CH4 (formula restrânsă);
| Formula restrânsă a metanului | Formula Lewis a metanului | Formula cu linințe (–) a metanului |
|---|---|---|
| CH4 |
- 2 atomi de carbon pun în comun câte un electron de valență și astfel de formează legătura covalentă C–C, iar restul de electroni de valență rămași (câte 3 pentru fiecare atom de carbon), îi pun în comun cu electronii care aparțin unor atomi de hidrogen. În acest fel se obține molecula de etan.
| Formula restrânsă a etanului | Formula Lewis a etanului | Formula cu linințe (–) a etanului |
|---|---|---|
| CH3–CH3 sau H3C–CH3 |
Conform rezultatelor obținute în urma unor studii experimentale, legăturile covalente simple care se stabilesc între un atom de carbon și 4 atomi de hidrogen sunt identice și sunt orientate în spațiu după vârfurile unui tetraedru regulat. Muchiile acestuia formează între ele un unghi de 109°, iar unghiul dintre două legături C–H, este de 109°28’. O valoare similară prezintă și unghiul format de valențele a 2 atomi de carbon uniți prin legătură simplă.
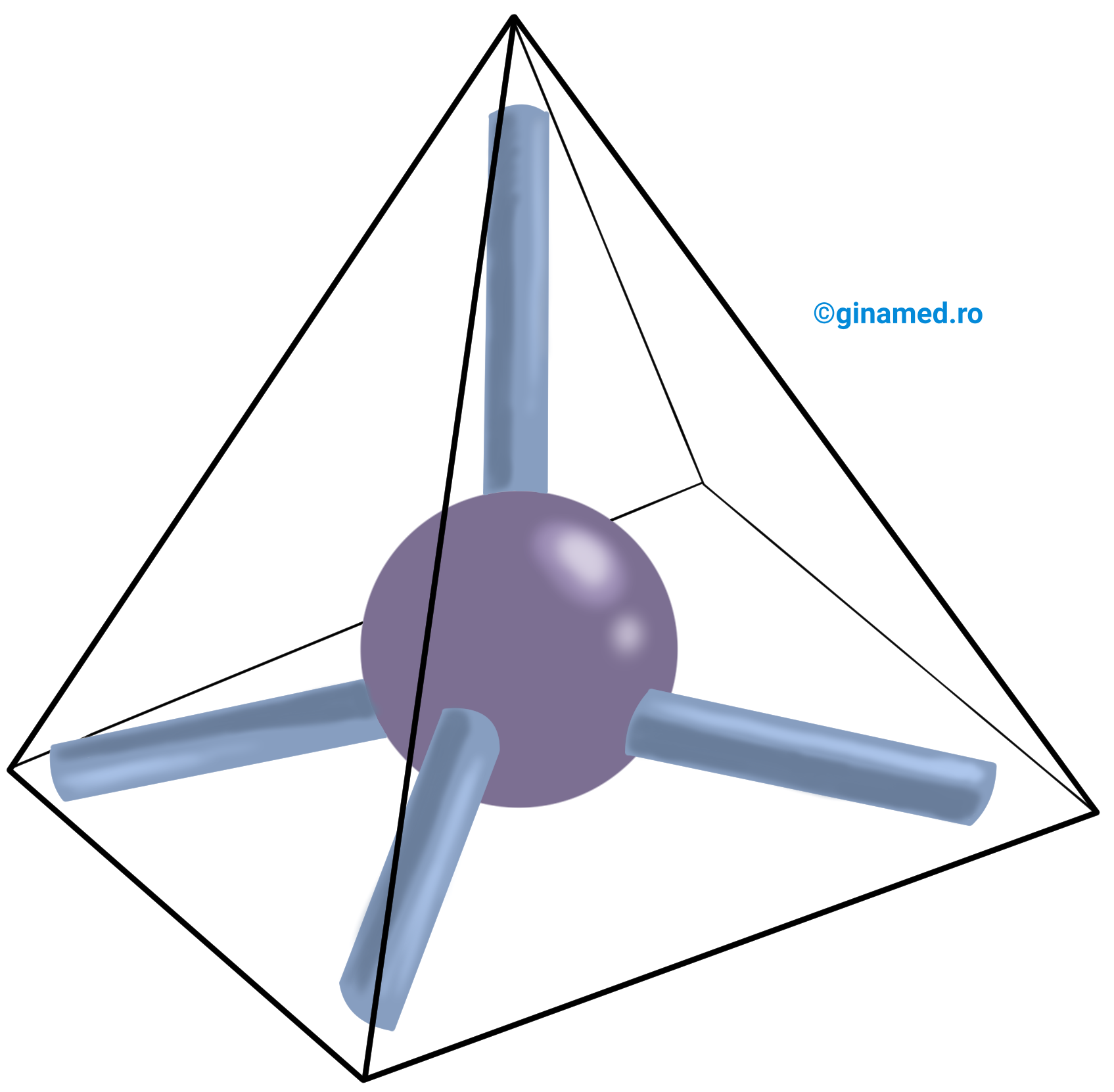
Din punct de vedere vizual, imaginile formulelor moleculelor care prezintă atomi de carbon și atomi de hidrogen pot fi reprezentate:
- în spațiu, formând tetraedre imaginare, sau
- simplist, cu ajutorul unor bile (care reprezintă atomi) și tije (care reprezintă legăturile dintre atomi), în modele care urmează valorile unghiurilor dintre valențe.
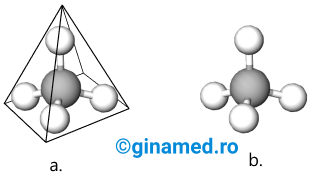
În același mod pot fi exemplificate și legăturile covalente simple stabilite între atomul de carbon și alți atomi sau grupe de atomi care pot pune în comun un electron.
Exemple:
- formarea de legături covalente simple σ (sigma) stabilite între carbon și clor;
| Formula Lewis | Formula Lewis | Formulă cu linii de valență | Formulă restrânsă |
|---|---|---|---|
| CH3–Cl |
- legături covalente simple σ stabilite între atomi de carbon, oxigen și hidrogen;
| Formula Lewis | Formula Lewis | Formulă cu linii de valență | Formulă restrânsă |
|---|---|---|---|
| CH3–OH |
Fiecare electron care nu participă la formarea unei legături (rămâne singur, neîmperecheat), este reprezentat printr-o liniuță care indică faptul că atomul prezintă o legătură liberă.
După stabilirea configurației de octet (octetul), perechea de electroni rămasă a unui atom, poartă numele de pereche de electroni neparticipanți. Aceasta nu prezintă o notație în scrierea formulei compusului.
Atunci când între 2 atomi se formează o legătură covalentă, aceasta poate fi văzută și ca o întrepătrundere a unor orbitali ai atomilor.
Astfel, prin suprapunerea (întrepătrunderea) totală a 2 orbitali coaxiali, fiecare aparținând unui atom, se formează legătura σ.
Prin suprapunerea (întrepătrunderea) parțială a 2 orbitali p paraleli, se formează legătura π. Cei 2 orbitali p paraleli sunt orientați în aceeași direcție, după aceeași axă de coordonate. Legătura π există doar alături de legătura σ. (Completare: în carte se menționează că este alături doar de legătura π, dar este greșit.)
Legătura dublă dintre 2 atomi este formată din următoarele două legături chimice:
- o legătură σ;
- o legătură π – rezultată prin suprapunerea parțială a 2 orbitali p, orientați după o axă perpendiculară pe cea a orbitalilor implicați în legătura σ; legătura π este situată într-un plan perpendicular pe planul în care se situează legătura σ.
Legătura triplă care se stabilește între 2 atomi este alcătuită dintr-o legătură σ și două legături π.
Astfel, un atom de C poate fi implicat și în formarea de legături multiple, cum ar fi:
| Legături duble | Legături triple |
|---|---|
| sau | |
| sau | sau |
sau CH2=CH2 | sau |
| sau | |
| sau |
În tabelul de mai jos sunt redate modalitățile de scriere a formulelor compușilor organici
| Formula Lewis | Formula cu liniuțe de valență (de proiecție) | Formula de proiecție restrânsă |
|---|---|---|
| CH3–CH3 | ||
| CH3–CH2–CH2–CH2–CH3 |
Tipuri de catene de atomi de carbon
Sunt atomi de carbon care nu vor implica cele 4 valențe ale acestora cu scopul de a forma catene. Valențele care nu sunt parte dintr-o catenă, interacționează cu hidrogenul și formează hidrocarburi sau interacționează cu alte elemente organogene și rezultă clase de compuși organici.
În funcție de tipul de legături care se stabilesc între atomii de carbon, catenele de atomi de carbon (catenele hidrocarbonate) rezultate se clasifică în:
- catene saturate: formate între atomii de carbon care sunt legați doar prin legături covalente simple σ, C–C; acestea intră în alcătuirea compușilor organici saturați;
Exemplu de catenă saturată:
- catene nesaturate: în alcătuirea catenei intră cel puțin o legătură π între 2 atomi de carbon; acestea intră în alcătuirea compușilor organici nesaturați;
Exemple de catene nesaturate:
- catene aromatice: catenele de atomi de carbon alcătuiesc (de cele mai multe ori) cicluri, care se numesc nuclee, de 6 atomi; în alcătuirea lor intră legături σ și electroni π care corespund legăturilor duble; acestea intră în alcătuirea compușilor aromatici.
Exemplu de catenă aromatică:
Clasificarea catenelor saturate și nesaturate
Atomii de carbon dintr-o catenă pot fi dispuși astfel:
- liniar (în linie), la rând – formând catene liniare; doar la scrierea pe hârtie, pentru a nu complica, catena este reprezentată în linie dreaptă, însă în realitate ea se dispune ca o linie în zig-zag;
Exemple de catene liniare:
- de o parte și de alta a catenei liniare – formând catene ramificate (asemănător cu ramurile unui copac);
Exemple de catene ramificate:
- într-o formă geometrică închisă: cum ar fi pătrat, pentagon sau hexagon – formând carene ciclice; acestea la rândul lor pot prezenta și ele ramificații.
Exemplu de catenă ciclică:
Tipuri de atomi de carbon din catene
În funcție de numărul de legături care se stabilesc între atomii de carbon într-o catenă, aceștia pot fi:
- atomi de carbon primari: sunt legați prin legătură covalentă de un singur atom de carbon;
- atomi de carbon secundari: sunt legați prin două legături covalente (două covalențe) de un alt sau alți atomi de carbon;
- atomi de carbon terțiari: sunt legați prin 3 legături covalente (3 covalențe) de un alt sau alți atomi de carbon;
- atomi de carbon cuaternari: sunt legați prin 4 legături covalente (4 covalențe) de alți atomi de carbon;
- atomi de carbon nulari: sunt atomii de carbon care nu prezintă nicio valență satisfăcută de alți atomi de carbon; nu se leagă de niciun alt atom de carbon.
| Atomi de C primari | Atomi de C secundari | Atomi de C terțiari | Atomi de C cuaternari |
|---|---|---|---|
1.3. Structura compușilor organici
Structura chimică (noțiune introdusă pentru prima dată în anul 1861 de către Butlerov) face referire la:
- natura;
- numărul;
- felul (modul), în care sunt legați atomii într-o moleculă.
De structura unui compus organic depind proprietățile sale fizice și chimice.
Structura unui compus organic se stabilește urmărind etapele de:
- stabilire a naturii și numărului de atomi dintr-o moleculă – informații care se obțin în urma unor analize calitative (care indică tipurile de atomi) și cantitative (care indică numărul de atomi din fiecare tip de atomi); la aceste analize sunt supuși compușii chimici puri. (Completare: Practic se efectuează analiza elementală.).
- stabilire a compoziției substanței, folosind datele obținute. Pe baza compoziției exprimate de obicei procentual (%) se poate deduce formula moleculară; (Completare: Înainte de aflarea formulei moleculare, se determină formula brută.).
- aranjarea atomilor în moleculă, informație redată de formulele de structură;
1.4. Analiza elementală a unei substanțe organice
Natura atomilor din moleculă
Metoda arderii, descoperită de către cercetătorul Lavoisier în anul 1784 este o procedură aplicată în vederea stabilirii naturii atomilor din alcătuirea unui compus organic. Gazele rezultate în urma arderii (combustiei) sunt analizate prin executarea unor reacții specifice. Astfel se efectuează analiza elementală calitativă a substanței.
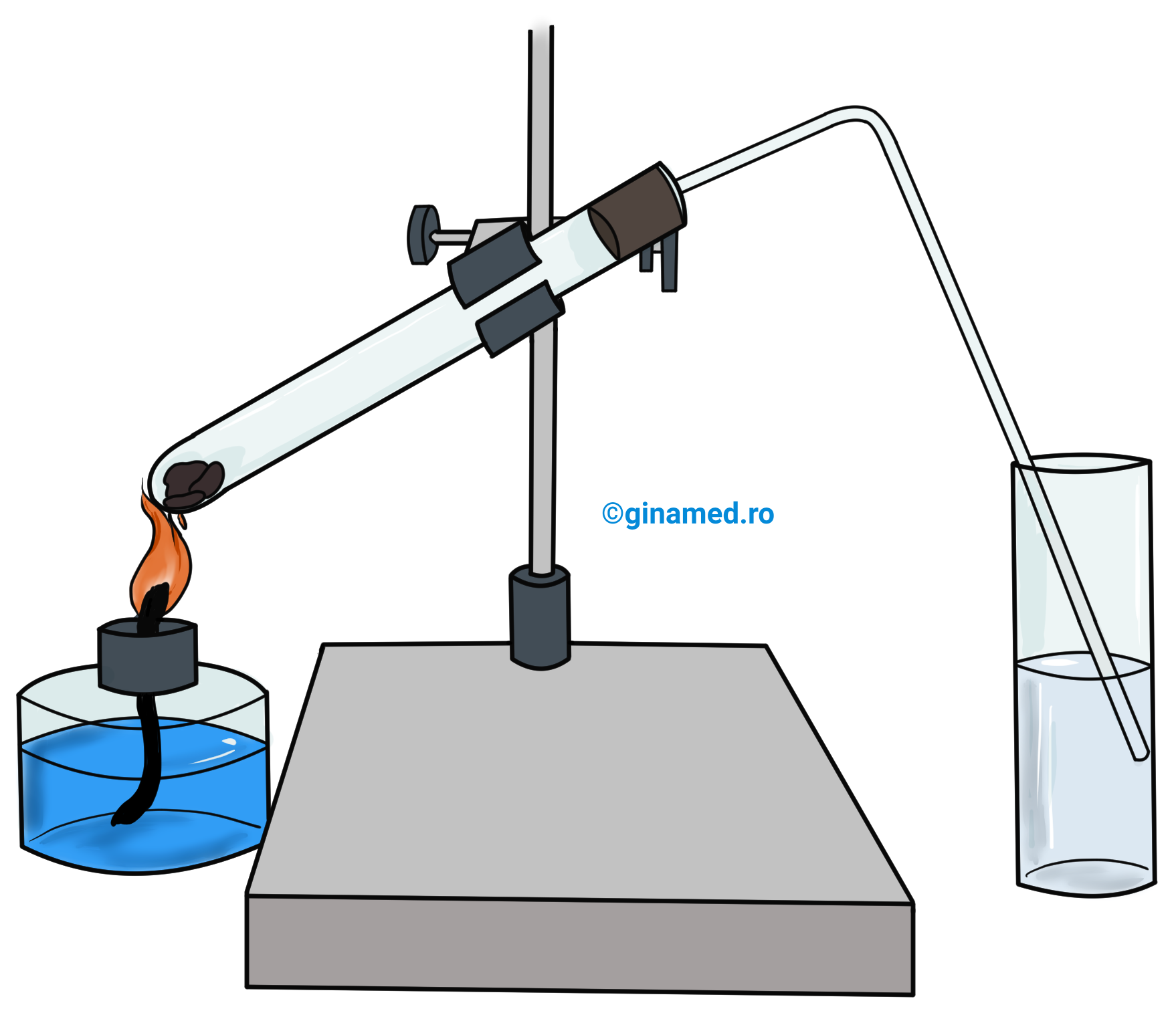
Pentru arderea substanței organice este necesară o instalație simplă. Arderea are loc în majoritatea cazurilor în prezență de catalizatori și/ sau substanțe care să reacționeze cu elementele din compoziția moleculei. În vasul de prindere se introduce apă sau o soluție cu care produșii de reacție să reacționeze.
Compoziția în procente de masă a substanței organice
Metoda analizei elementale cantitative a fost clarificată de către Justus von Liebig în anul 1830. Acesta a folosit, pe lângă ardere și o serie de reacții specifice în urma cărora elementele organogene din alcătuirea compușilor organici sunt transformate în compuși care pot fi determinați cantitativ. Determinarea cantitativă presupune determinarea masei și/ sau a concentrației. Astfel, poate fi stabilită concentrația procentuală a fiecărui element din molecula unui compus organic. Excepție face oxigenul, a cărui compoziție procentuală se obține (se calculează) ca diferență până la 100.
Problemă rezolvată
Rezolvare:
Apoi se aplică regula de 3 simplă:
Apoi se calculează conținutul % al fiecărui element în cantitatea de substanță A:
0,30 g A .............. 0,02 g H ......... 0,12 g C
100 g .................... e .......................... f
Rezultă:
e = 0,02 ∙ 100 / 0,30 = 6,66% H
f = 0,12 ∙ 100 / 0,030 = 40,00% C
Oxigenul se află prin diferență: 100 – (6,66 + 40,00) = 53,33% O
1.5. Determinarea formulei brute
Formula brută a unei substanțe indică natura atomilor și raportul în care aceștia se găsesc în moleculă, exprimat prin numere întregi.
Formula brută poate fi stabilită știind:
- compoziția procentuală de masă a substanței organice;
- masele atomice ale elementelor din alcătuirea substanței organice.
Problemă rezolvată
Un compus organic conține 85,71% C (carbon) și 14,29% H (hidrogen). Stabilește formula brută a acestuia.
Rezolvare:
Se împarte fiecare valoare procentuală la masa atomică a elementului corespunzător (masa atomică a carbonului este 12, iar masa atomică a hidrogenului este 1):
C (carbon): 85,71% => 85,71/ 12 = 7,14
H (hidrogen): 14,29% => 14,29/ 1= 14,29
Apoi se împarte fiecare rezultat la numărul cel mai mic:
C: C = 7,14/ 7,14 = 1
H: C = 14,29/ 7,14 = 2
Raportul de combinare al atomilor se exprimă prin numere întregi: C : H = 1 : 2
1.6. Determinarea formulei moleculare
Formula moleculară a unei substanțe indică felul atomilor din moleculă și numărul exact al acestora.
Cu alte cuvinte, formula moleculară reprezintă un multiplu întreg al formulei brute. Unei formule brute pot să îi corespundă mai multe formule moleculare.
Problemă rezolvată
Rezolvare:
M = (12 + 2) ∙ n = 14n
1.7. Determinarea formulei structurale
Spre deosebire de formulele moleculare, formulele structurale arată modul de legare a atomilor în moleculă.
O formulă moleculară poate prezenta mai multe formule structurale.
Formula structurală plană – reprezintă formula structurală a unei substanțe chimice care poate fi scrisă în plan în mai multe feluri.
Astfel, reprezentarea grafică a formulelor plane poate fi făcută folosind:
- formule Lewis;
- formule de proiecție – în care printr-o linie este marcată legătura chimică;
- formule de proiecție restrânse – aceste tipuri de formule se folosesc deseori în scrierea formulelor moleculelor compușilor organici; mai poartă numele de formule de structură plană.
Aceste tipuri de formule sunt redate în tabelul de mai sus, unde sunt prezentate modalitățile de scriere a formulelor compușilor organici.
Formula spațială – redă modul de orientare în spațiu a legăturilor chimice. În mod practic, aceste tipuri de modele spațiale ale moleculelor compușilor organici pot fi construite cu ajutor unor bile colorate și tije din trusa de laborator.
De exemplu, modelele spațiale ale moleculelor pot fi prezentate ca: model deschis sau model compact.
Conform geometriei lor, moleculele pot prezenta formule de structură de tip:
- liniar;
- ramificat;
- ciclic.
Fiecare dintre acestea pot fi saturate, nesaturate sau aromatice.
Formulele moleculare plane se pot scrie mai simplu prin formule condensate simplificate, denumite și formule graf. Conform teoriei grafurilor, pe baza formulelor condensate simplificate se permite calcularea unor parametri ai moleculelor, cum ar fi: distanțe interatomice, unghiuri de valența, energii de legătură și altele.
Formulele condensate simplificate sunt reprezentate prin linii frânte sau modele în care simbolurile pentru carbon (C) și hidrogen (H) nu sunt scrise.
| Formula condensată simplificată pentru CH3–CH3 (etan) | Formula condensată simplificată pentru CH3–CH2–CH2–CH2–CH3 (n-pentan) |
|---|---|
Pentru acele structuri de molecule simple, în spațiu se mai pot folosi formulări care sugerează modelul tetraedric al atomului de carbon (formule de configurație). În această reprezentare se întâlnesc:
- linia continuă (–), care reprezintă lanțul de atomi de carbon aflat în planul hârtiei;
- linia punctată (- - -), care reprezintă atomii aflați în spatele lanțului de atomi de carbon din planul hârtiei;
- linia (legătura) îngroșată (), care marchează atomii aflați în fața planului hârtiei.
| Formula de configurație pentru un atom de carbon | Formula de configurație pentru catena cu 4 atomi de C legați numai prin legături simple σ |
|---|---|
O formulă moleculară poate prezenta mai multe formule structurale.
Izomerii (din greacă: izo = același, mer = parte) sunt compușii organici care au în moleculă:
- același tip de atomi;
- același număr de atomi;
- moduri de legare diferite între ei ale atomilor.
Izomerii se clasifică în:
- izomeri de constituție, care pot fi: de catenă, de poziție, de funcțiune; (Completare: izomerii de constituție (de structură) diferă prin ordinea sau modul sau succesiunea de legare a atomilor în moleculă, făra a se lua în considerare dispunerea lor spațială; astfel de compuși prezintă proprietăți fizice și chimice diferite)
- izomeri spațiali;
![Izomerii de funcțiune ai compusului cu formula moleculară [HTML]C<sub>2</sub>H<sub>6</sub>O[/HTML] (bila roșie reprezintă atomul de oxigen, bila albă atomul de hidrogen și bila gri atomul de carbon).](/content/image-upload/izomeri_functiune_chimie.png)
1.8. Clasificarea compușilor organici
În structura compușilor organici intră un număr mic de grupări de atomi care sunt denumite grupe funcționare. Acestea determină reactivitatea compușilor organici și totodată permite clasificarea și caracterizarea mai facilă a acestora. Totodată, cunoașterea grupelor funcționare din structura unui compus chimic ajută la identificarea proprietăților chimice ale acestuia.
Grupa funcțională reprezintă un atom sau o grupă de atomi care odată ce intră fac parte dintr-o moleculă, imprimă acesteia anumite proprietăți fizice și chimice specifice.
Grupele funcționale se clasifică în:
- omogene: prezintă legături duble: C=C și triple: ;
- eterogene: prezintă atomi specifici (cum ar fi: -Cl, -Br, -I), grupe de atomi (cum ar fi: -OH, -COOH) sau ioni organici;
În funcție de grupele funcționale prezente în moleculă (deci în funcție de compoziție), compușii organici se clasifică în:
- Hidrocarburi – care pot fi: saturate, nesaturate, aromatice;
- Derivați funcționali ai hidrocarburilor – care pot fi: compuși halogenați, alcooli, eteri, compuși carbonilici (aldehide, cetone), amine, acizi sulfonici, acizi carboxilici.
Hidrocarburile se clasifică în:
| Hidrocarburi saturate | Hidrocarburi nesaturate | Hidrocarburi aromatice |
|---|---|---|
Derivații funcționali ai hidrocarburilor se clasifică în (R= radical de hidrocarbură):
| Compuși halogenați | Alcooli | Eteri | Compuși carbonilici | Amine | Acizi sulfonici | Acizi carboxilici |
|---|---|---|---|---|---|---|
| R-X; X = -F, -Cl, -Br, -I | R-O-H | R-O-R | R–NH2 | R–SO3H |
1.9. Despre legătura chimică
Legătura chimică reprezintă o forță (un vector) care se stabilește între atomi sau grupuri de atomi cărora le permite menținerea împreună și funcționarea ca o unitate cu stabilitate mare. În acest fel se consideră o specie independentă – o moleculă.
Fiind o forță, legătura chimică covalentă, deține toate caracteristicile (atributele) unui vector:
- acționează pe o dreaptă suport – motiv pentru care legăturile chimice sunt orientate în spațiu; valențele fac între ele unghiuri;
- prin modulul vectorului, legăturile chimice prezintă diferențe între ele din punct de vedere al intensității. În acest fel, legătura simplă σ este caracterizată de o stabilitate mai mare comparativ cu legătura dublă (σ + π), care la rândul său este mai slabă decât legătura triplă (σ + 2π).
Forțele de atracție mari dintre atomi, duc la distanțe mici între aceștia și invers. Deci forțele de atracție sunt invers proporționale cu distanța dintre atomi. În acest fel, lungimea legăturii scade în seria: legătură triplă < legătura dublă < legătura simplă.
Probleme rezolvate
Rezolvare:
Calculează masele de: carbon din dioxidul de carbon și hidrogen din apă, obținute în urma analizei elementale.
Rezultă x = 1,2 g C
Rezultă y = 0,1 g H
2,1 g – (1,2 g + 0,1 g) = 0,8 g O
Calculează formula procentuală a substanței A:
2,1 g substanță organică......1,2 g C....... 0,1 g H.... 0,8 g O
100 g substanță organică...... a g C........ b g H....... c g O
Rezultă:
a = 57,14% C
b = 4,76% H
c = 38,10% O
Pentru determinarea formulei brute, se împarte fiecare valoare procentuală obținută la masa atomică a elementului corespunzător. Apoi se împart rezultatele la cel mai mic dintre ele. Aceste ultime rezultate sunt indicii formulei brute.
2. O substanță organică necunoscută are raportul masic C:H:N = 6:2:7 și masa molară egală cu 60. Determină formula molară a substanței necunoscute.
Rezolvare:
Se calculează masa fiecărui element organogen conținut într-un mol de substanță necunoscută:
15 g substanță organică ...... 6 g C....... 2 g H..... 7 g N
60 g substanță organică ...... a g C....... b g H..... c g N
Rezultă:
a = 24 g C
b = 8 g H
c = 28 g N
Se stabilește numărul atomilor din fiecare element organogen conținut într-o moleculă de substanță necunoscută prin împărțirea masei atomului conținut de substanța organică la masa unui atom:
1.10. Reacțiile compușilor organici
Cele 4 tipuri de reacții de bază ale compușilor organici, sunt:
- reacții de substituție
- reacții de adiție
- reacții de eliminare
- reacții de transpoziție
Cele mai importante reacții de substituție, sunt:
- halohenarea alcanilor
- halogenarea compușilor aromatici
- alchilarea compușilor aromatici
- nitrarea compușilor aromatici
- sulfonarea compușilor aromatici
- esterificarea
- hidroliza
Cele mai importante reacții de adiție, sunt:
- adiția halogenilor
- adiția hidracizilor la alchene și alchine
- hidrogenarea compușilor nesaturați
- condensarea aldolică
- polimerizarea monomerilor vinilici
Cele mai importante reacții de eliminare, sunt:
- dehidrohalogenarea compușilor halogenați
- deshidratarea alcoolilor
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005

