17. Izomerie optică
Cuprins:
17.1. Introducere17.2. Compuși organici cu un atom de carbon asimetric
17.3. Compuși organici cu 2 atomi de carbon asimetrici
17.4. Importanța practică
17.1. Introducere
Un fenomen întâlnit frecvent în chimia organică este izomeria. Aceasta justifică totodată și marea diversitate a substanțelor organice. Termenul de izomerie a fost introdus de către Jӧns Jacob Berzelius (1779 – 1848), care provine din greacă: isos = egal și meros = parter.
Izomerii sunt substanțe organice care prezintă aceeași formulă moleculară, însă structuri chimice diferite și care din acest motiv proprietățile fizico-chimice vor fi diferite.
Diferențele care apar între izomeri pot fi date de:
- aranjamentul (succesiunea) atomilor în moleculă;
- tipul legăturii covalente dintre atomi (poate să fie legătură simplă, dublă, triplă);
- orientarea atomilor față de un plan sau față de un centru al moleculei.
Exemple de compuși care diferă între ei prin aranjamentul atomilor în moleculă:
| Compusul 1 | Compusul 2 |
|---|---|
Exemple de compuși care diferă între ei prin tipul legăturilor covalente carbon-carbon și carbon-oxigen:
| Compusul 1 | Compusul 2 |
|---|---|
În toate exemplele de izomeri de mai sus, atomii au conectivități (vecinătăți) diferite. Aceștia izomeri sunt izomeri de constituție sau de structură.
Exemple de izomeri care diferă între ei prin orientarea unor atomi față de planul legăturii π din legătura dublă:
| Compusul 1 | Compusul 2 |
|---|---|
Exemple de izomeri care diferă unul de celălalt prin orientarea atomilor față de atomii de carbon evidențiați:
| Compusul 1 | Compusul 2 |
|---|---|
În toți acești izomeri, atomii din structura lor au aceleași conectivități. Astfel, aceștia sunt și izomeri sterici.
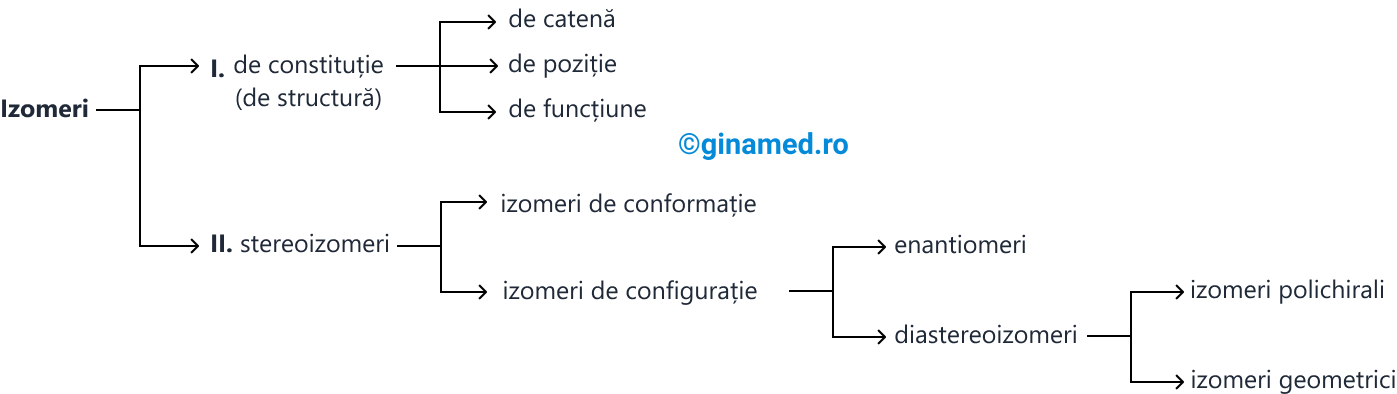
Astfel, în funcție de factorii enumerați mai sus, izomerii se diferențiază în:
- izomeri de constituție (de structură), care la rândul lor pot fi: izomeri de catenă, izomeri de poziție și izomeri de funcțiune (compuși cu același număr de atomi de carbon care prezintă aceeași formulă moleculară, însă atomii se leagă diferit și fac parte din clase de substanțe diferite);
- stereoizomeri, care la rândul lor pot fi izomeri de conformație și izomeri de configurație. Izomerii de configurație se împart în enantiomeri și diastereoizomeri. Diastereoizomerii se clasifică în izomeri polichirali și izomeri geometrici.
Stereoizomerii (izomerii sterici) sunt izomerii în care atomii prezintă aceleași conectivități, dar diferă prin orientarea atomilor în spațiu, față de un plan sau față de un centru al moleculei.
Stereoizomerii de împart în:
- izomeri de conformație – stereoizomerii care pot trece unul în celălalt prin rotirea atomilor în jurul unei legături simple din moleculă;
- izomeri de configurație – stereoizomerii care se diferențiază prin modul diferit de orientare a atomilor față de un element structural rigid (centru sau plan) și a căror interconversie presupune desfacerea și refacerea unor legături.
Izomerii de configurație se clasifică în:
- enantiomeri – sunt stereoizomerii care se află unul față de celălalt în relația obiect – imaginea sa în oglindă și prezintă proprietăți fizico-chimice identice.
- diastereoizomeri – sunt stereoizomerii în care distanțele dintre atomii nelegați direct între ei diferă de la un izomer la altul. Aceștia nu se află unul față de celălalt în relația obiect – imagine în oglindă (nu sunt enantiomeri). (Completare: Diastereoizomerii sunt izomeri care prezintă aceeași formulă moleculară, același număr de atomi de carbon asimetrici și nu sunt enantiomeri.)
Dintre izomerii de configurație, diastereoizomerii se clasifică în:
- izomeri polichirali – sunt diastereoizomeri cu mai multe centre de chiralitate;
- izomeri geometrici – sunt stereoizomeri care prezintă aranjamente diferite ale atomilor față de un plan al moleculei.
17.2. Compuși organici cu un atom de carbon asimetric
Se consideră izomerii de mai jos:
| Izomerul A | Izomerul B |
|---|---|
Structura izomerului A este de fapt imaginea în oglindă a izomerului B și invers. Sau altfel spus, structurile acestor 2 izomeri sunt simetrice față de un plan. Structurile izomerilor A și B nu sunt identice, deoarece nu se suprapun. Astfel, acești stereoizomeri se numesc enantiomeri.
Stereoizomerii care prezintă un atom de carbon asimetric și care sunt ca în relația obiect – imagine în oglindă nesuperpozabile, poartă numele de enantiomeri.
Astfel, în alcătuirea enantiomerilor A și B intră aceiași atomi cu conectivități identice, dar sunt substanțe diferite.
Pentru a identifica prin ce se diferențiază structurile celor 2 enantiomeri, A și B, este necesar să se analizeze moleculele acestora din partea opusă atomilor de hidrogen.
Un atom de carbon asimetric este un atom de carbon saturat care are toate cele 4 valențe satisfăcute cu 4 substituenți (atomi sau grupe de atomi) diferiți.
Atomul de carbon asimetric este un centru de chiralitate. Molecula care conține un astfel de atom de carbon asimetric este chirală. Moleculele chirale nu admit un plan sau un centru de simetrie.
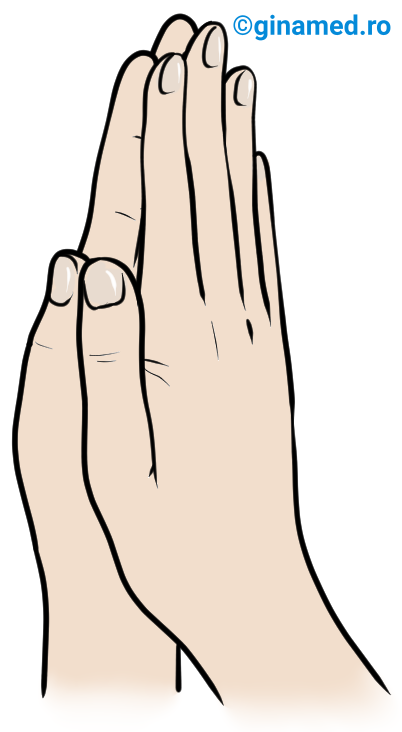
Fenomenul de chiralitate este parte din viața cotidiană.
Mâna dreaptă și stângă sunt sisteme asimetrice, nu sunt superpozabile (nu se suprapun) și se află între ele în relația obiect – imagine în oglindă. În alcătuirea ambelor mâini intră aceleași elemente (degetele: mare, arătător, mijlociu, inelar, mic), dispuse diferit în jurul palmei care reprezintă centrul chiral.

Alte exemple de obiecte asimetrice:
- o pereche de pantofi;
- cele două jumătăți ale unei foarfece.
Enantiomerii A și B conțin fiecare câte un atom de carbon asimetric care prezintă configurație diferită, deoarece substituenții sunt dispuși în jurul său în sensuri diferite.
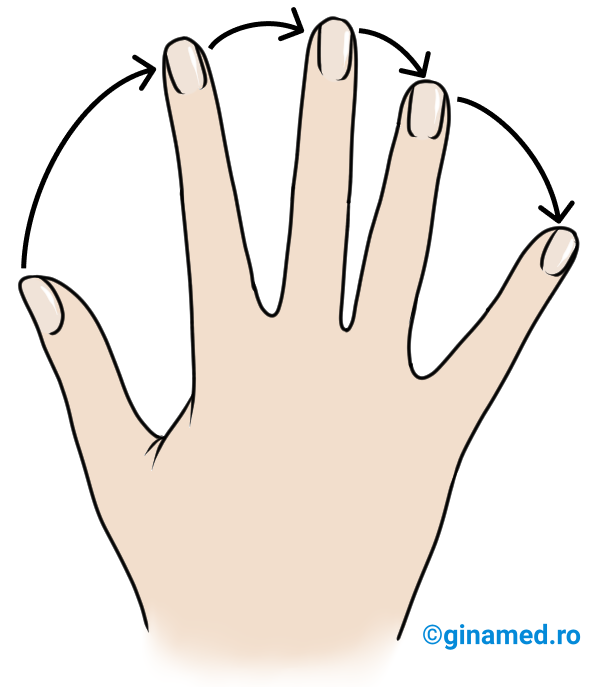
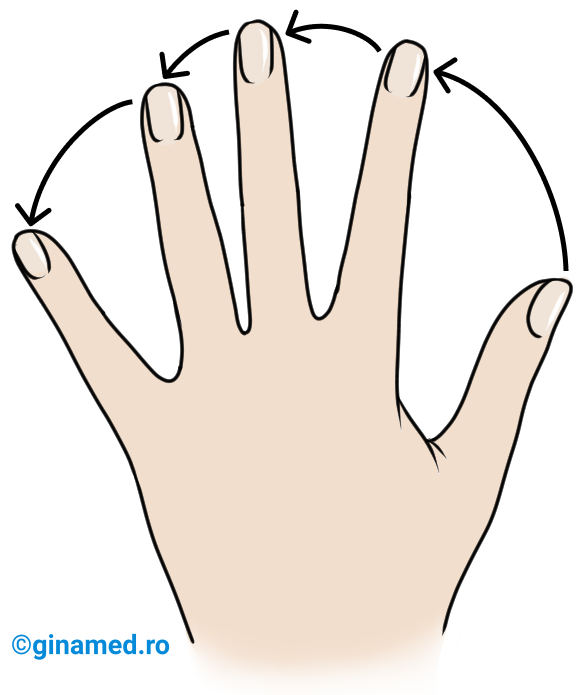
Configurația unui atom de carbon asimetric se stabilește după următoarele reguli:
- se stabilesc prioritățile substituenților în ordinea descrescătoare a numerelor atomice ale atomilor legați de atomul de carbon asimetric.
- modelul structural se privește din partea opusă substituentului cu prioritatea cea mai mică și se parcurg ceilalți substituenți în ordinea descrescătoare a priorității lor. Cum se observă săgeata în figura de mai sus.
- dacă sensul de dispunere a substituenților coincide cu sensul acelor de ceasornic, atunci atomul de carbon asimetric are configurație R (din latină, rectus = dreapta).
- dacă sensul de dispunere a substituenților este opus sensului acelor de ceasornic, atunci atomul de carbon asimetric are configurație S (din latină, sinister = stânga).
Astfel, enantiomerii A și B prezintă atomi de carbon asimetrici cu configurații diferite, care se denumesc:
A: (R)-1-cloroetanol
B: (S)-1-cloroetanol
Deoarece este mai dificil de reprezentat formulele de perspectivă, se recurge la formulele de proiecție, denumite formule Fischer. Pentru reprezentarea acestora se respectă următoarele proceduri:
- modelul structural cu 2 substituenți se orientează în plan orizontal, îndreptați spre privitor. Ceilalți 2 substituenți rămași se vor afla în planul vertical și vor fi orientați în spatele hârtiei.
- se recomandă privirea moleculei din partea substituentului cu prioritatea cea mai mică.
- toate legăturile sunt rabatate în planul hârtiei. Astfel, legăturile îndreptate spre privitor se vor trasa lateral, iar legăturile îndreptate în planul opus privitorului se vor trasa vertical.
2 enantiomeri pereche (cum sunt exemplele A și B), nu sunt structuri chimice identice și de aceea ei se diferențiază prin unele proprietăți. Prezintă proprietăți chimice și fizice identice, însă rotesc planul luminii polarizate în sensuri diferite cu același unghi și au proprietăți biologice diferite.
Proprietatea unei substanțe de a roti planul luminii polarizate atunci când este străbătută de aceasta, poartă numele de activitate optică. Enantiomerii sunt substanțe optic active și mai sunt denumiți izomeri optici sau antipozi optici.
Izomeria optică a fost descoperită de către J. B. Biot în anul 1815. Abia în anul 1874 a fost explicată pe baza concepției despre structura tetraedrică a atomului de carbon. În același an și în același timp, cercetătorii: olandezul Van’t Hoff și francezul Le Bel, fără să se cunoască, au pus bazele unei noi teorii – „izomeria optică”.
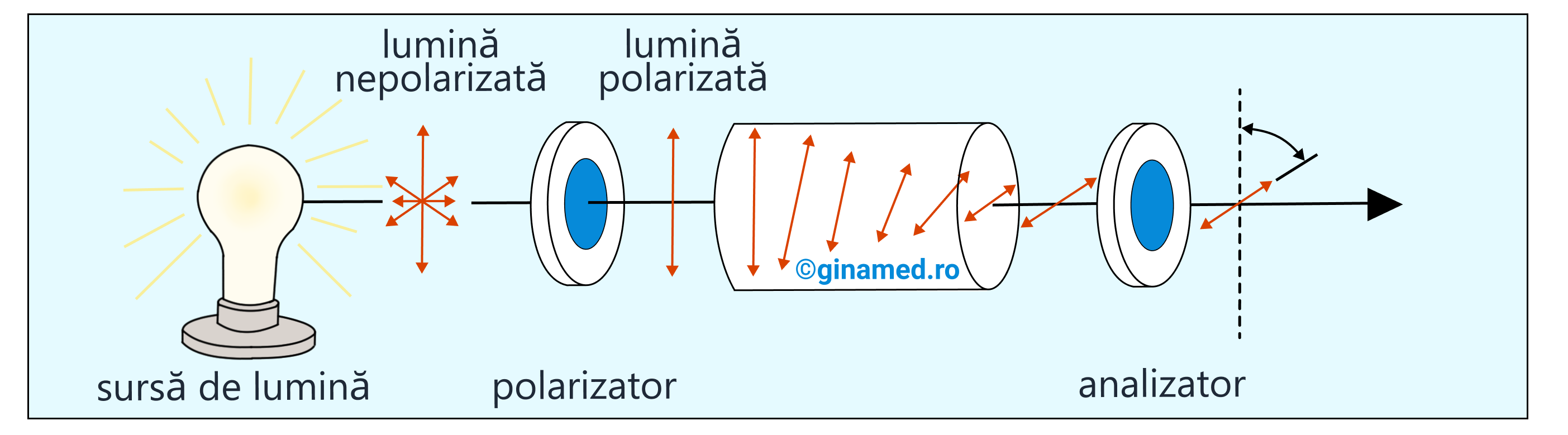
Enantiomerul care rotește planul luminii polarizare spre dreapta se numește dextrogir și este marcat cu semnul (+).
Enantiomerul care rotește planul luminii polarizare spre stânga se numește levogir și este marcat cu semnul (-).
Enantiomerii rotesc planul luminii polarizate în sensuri diferite, cu același unghi.
Amestecul echimolecular al unei perechi de enantiomeri este lipsit de activitate optică datorită compensării intermoleculare. Poartă numele de amestec racemic și este marcat prin semnul (±).
Între configurația atomului de carbon asimetric al unei substanțe optic active și sensul în care aceasta rotește planul luminii polarizate, NU se poate stabili o relație.
17.3. Compuși organici cu 2 atomi de carbon asimetrici
În structurile stereoizomerilor de mai jos se remarcă foarte clar faptul că distanțele dintre atomii nelegați direct între ei variază de la un izomer la altul. Totodată, acești izomeri nu se află unul față de celălalt în relația obiect – imagine în oglindă. Acest tip de izomeri se numesc diasteroizomeri.
| Compusul C | Compusul D |
|---|---|
| Compusul E | Compusul F |
|---|---|
Stereoizomerii care nu sunt în relația obiect – imagine în oglindă poartă numele de diastereoizomeri.
Izomeria geometrică este o componentă a diastereoizomeriei.
Compușii E și F prezintă în moleculă 2 atomi de carbon asimetrici și sunt compuși optic activi.
Astfel, un compus ce prezintă 2 atomi de carbon asimetrici, va exista sub forma a 4 stereoizomeri, adică două perechi de enantiomeri.
Compușii care prezintă 2 atomi de carbon asimetrici au 4 stereoizomeri deoarece fiecare dintre atomii asimetrici pot să prezinte atât configurație R, cât și S. Astfel se obțin cei 4 stereoizomeri cu configurațiile: SR, RS, SS și RR.
În situația în care sunt compuși care au atomi de carbon cu substituenți identici, numărul enantiomerilor se reduce.
Astfel, mezoforma admite un plan de simetrie și este o specie achirală și deci, optic inactivă.
Enantiomerii și diastereoizomerii fac parte din categoria de izomeri de configurație. Transformarea unui conformer în altul presupune desfacerea unor legături și refacerea altora.
17.4. Importanța practică
Datorită faptului că proprietățile biologice ale enantiomerilor sunt în general diferite, prezența enantiomerilor în lumea vie este extraordinar de importantă.
În compușii naturali se întâlnește doar unul dintre enantiomeri, care doar acesta exercită funcțiile biologice normale, iar celălalt enantiomer, nu. De exemplu, pe un substrat alcătuit din aminoacizi naturali se poate dezvolta o cultură de microbi, însă pe un substrat alcătuit din enantiomerii opuși aminoacizilor naturali, cultura nu supraviețuiește (moare).
Structura chirală influențează și industria medicamentelor. Doar unul dintre enantiomeri prezintă acțiunea biologică benefică, dorită pentru organism, însă celălalt enantiomer este inactiv sau chiar foarte dăunător. Prin extragerea unui medicament dintr-o plantă se va reține doar enantiomerul dorit, cu acțiunea benefică, însă prin sinteza din industria farmaceutică, în general, se obține un amestec racemic alcătuit din cei 2 enantiomeri.
Bibliografie:
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

