20. Zaharide
Cuprins:
20.1. Introducere20.2. Monozaharidele - Aspecte generale
20.3. Izomeria monozaharidelor
20.4. Structura monozaharidelor
20.5. Proprietăți fizice ale monozaharidelor
20.6. Proprietățile chimice ale monozaharidelor
20.7. Glucoza (C6H12O6)
20.1. Introducere
Cei mai importanți compuși cu acțiune biologică sunt:
- zaharide;
- proteine;
- grăsimi.
Obținerea acestor compuși macromoleculari se realizează prin reacția de policondensare, care constă în eliminarea unor molecule mici (în general, apa) dintre moleculele unor compuși di- sau polifuncționali.
Zaharidele prezintă următoarele caracteristici:
- constituie o clasă de compuși naturali polifuncționali;
- sunt larg răspândite;
- frecvent, se utilizează denumirile din biochimie care sunt inspirate de cele mai multe ori de numele produșilor din natură din care au fost izolate inițial;
- reprezintă o componentă indispensabilă din alimentația omului;
- constituie o componentă esențială a hranei împreună cu grăsimile, proteinele, vitaminele și anumite săruri minerale;
- se regăsesc în structura pereților celulelor tuturor organismelor vii;
- reprezintă o sursă de energie din alimentația organismelor superioare necesară în procesele vitale;
- rezervele de substanță energetică ale organismelor vii se realizează sub formă de polizaharide cum ar fi glicogenul (pentru animale) și amidonul (pentru plante); la nevoie, pot fi accesate;
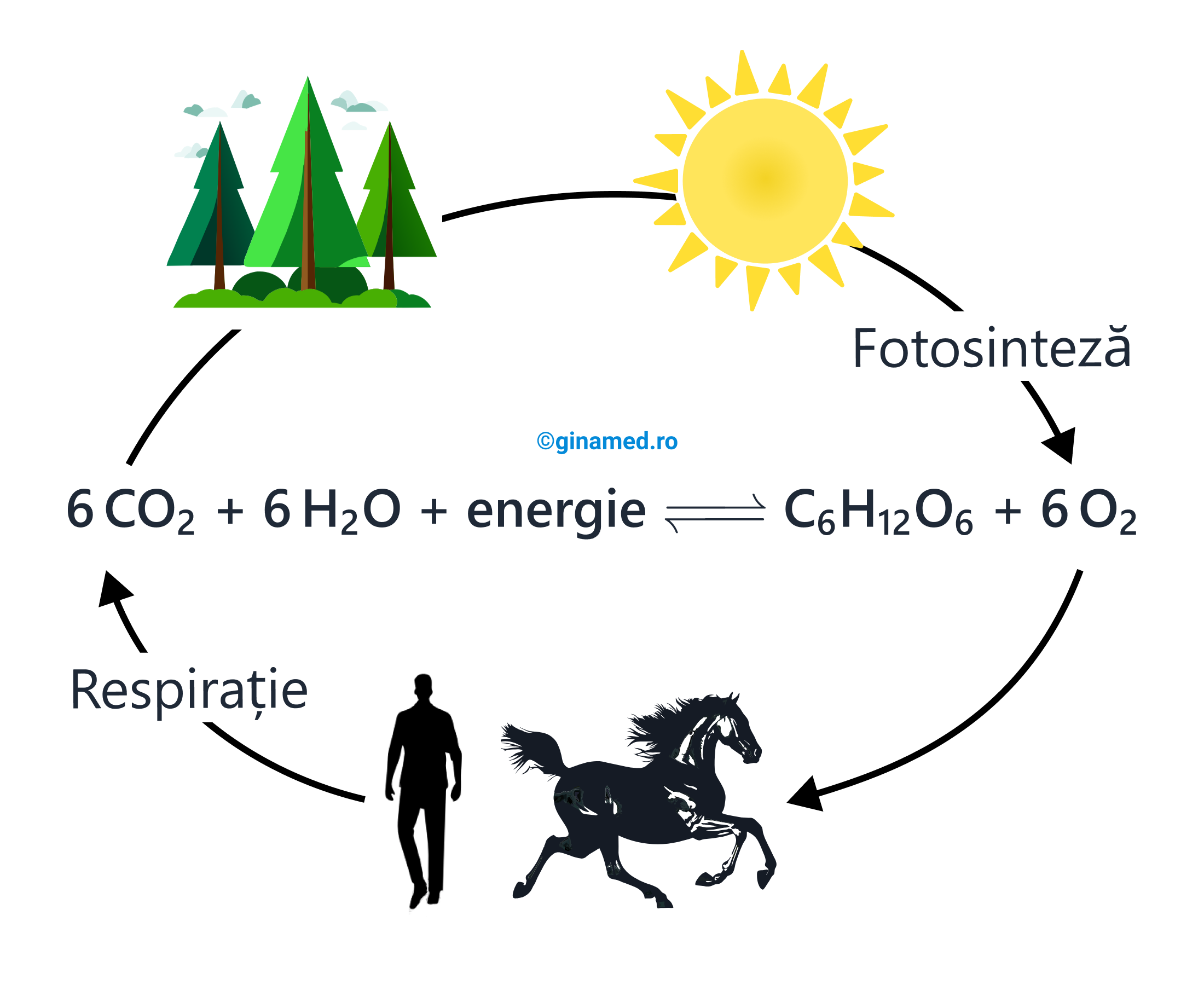
- în plante, sunt sintetizate prin procesul de fotosinteză (într-o cantitate de 1011 tone/an). Pe lângă obținerea de zaharide (glucoză), în urma procesului de fotosinteză rezultă și oxigen care este utilizat în procesele de ardere (respirație) din organismele vii (animale, om). Procesul de fotosinteză din plante folosește energie dată de lumina solară prin intermediul clorofilei. Ca rezultat al arderilor (degradării oxidative), se eliberează energie și se obțin CO2 și apă, necesare în cadrul procesului de fotosinteză în plante și astfel, se restabilește echilibrul natural (6CO2 + 6H2O + energie ↔ C6H12O6 + 6O2). Energia rezultată din degradarea oxidativă a zaharidelor se transformă în căldură (o parte) și o altă parte este înmagazinată la nivelul legăturilor din moleculele de ATP (acid adenozintrifosforic), folosit în sintezele din organism.
Privind comportamentul zaharidelor în reacția cu apa (hidroliza), acestea se clasifică în:
- monozaharide – nu hidrolizează în reacție cu apa; sunt zaharide simple, compuși polihidroxicarbonilici, care pot fi de tip: polihidroxi-aldehide (de exemplu, glucoză) sau polihidroxi-cetone (de exemplu, fructoză).
- zaharide de policondensare – hidrolizează în reacție cu apa și se obțin compuși formați din mai multe monozaharide. Unirea lor s-a realizat prin eliminarea unei molecule de apă dintre două grupe hidroxil (–OH) cu obținerea de punți eterice (C–O–C). În general, zaharidele de policondensare se pot reduce la formula: (C6H10O5)n. În funcție de valoarea lui n, zaharidele de policondensare se clasifică în:
- oligozaharide (2≤n<10, de exemplu pentru n=2 se obține zaharoza) – prin hidroliză rezultă monozaharidele constituente; monozaharidele din alcătuirea lor sunt unite prin punți eterice (C–O–C);
- polizaharide (n≥10, de exemplu amidon sau celuloză) – resturile de monozaharide sunt unite prin punți eterice care formează lanțuri liniare sau ramificate; prin hidroliză se eliberează monozaharidele constituente.
20.2. Monozaharidele - Aspecte generale
Chimic – monozaharidele sunt polihidroxialdehide (ALDOZE) sau polihidroxicetone (CETOZE).
În denumirea lor se remarcă sufixul caracteristic „-oză”. Raportat la numărul de atomi de carbon din moleculă, monozaharidele se numesc: tetroze, pentoze, hexoze, ș.a.m.d.
D-glucoza: aldohexoză – 6 atomi de carbon în moleculă; o grupă carbonil de tip aldehidă;
D-fructoza: cetohexoză – 6 atomi de carbon în moleculă; o grupă carbonil de tip cetonă;
Privind distribuția în natură a monozaharidelor, acestea se caracterizează prin:
- triozele libere nu se găsesc; însă esterii acestora cu acidul fosforic funcționează ca intermediar în transformările biochimice ale zaharidelor.
- tetrozele lipsesc din natură.
- unele pentoze și hexoze apar în formă liberă sau în combinații, în cantitate mare, de unde și importanța lor biologică. Cele mai importante ar fi: D-riboza, D-ribuloza, D-xiloza, D-glucoza, D-fructoza, D-galactoza, D-manoza.
- o cetoheptoză cu importanță biologică: D-sedoheptuloza.
Formulele de proiecție (formule Fischer) și denumirile unor monozaharide:
| D(-) riboză | D - ribuloză | D(+) manoză | D(+) galactoză | D(+) aloză | D - sorboză |
|---|---|---|---|---|---|
Frecvent, denumirile zaharidelor sunt cele din biochimie care sunt inspirate, în general, din numele produșilor din natură din care au fost izolate inițial.
20.3. Izomeria monozaharidelor
Aldozele și cetozele care prezintă același număr de atomi de carbon în moleculă, au aceeași formulă moleculară și sunt izomere. Astfel, D-glucoza și D-fructoza sunt monozaharide izomere.
Monozaharidele prezintă în molecula lor unul sau mai mulți atomi de carbon asimetrici și sunt optic active.
Glicerinaldehida – este cea mai simplă monozaharidă care prezintă un atom de carbon asimetric și există sub forma a doi enantiomeri.
Din seria L fac parte monozaharide care au la atomul de carbon chiral o configurație identică cu cea a L-glicerinaldehidei.
Fiecare termen din seria L este enantiomerul corespunzător al unui termen din seria D. Enantiomerii sunt stereoizomerii care nu se suprapun, dar se găsesc în relația obiect - imagine în oglindă.
În ceea ce privește răspândirea în natură, monozaharidele L-fructoză și L-glucoză lipsesc, deși sunt enantiomerii D-fructozei și D-glucozei care sunt mai răspândiți.
Stereoizomerii care prezintă aceeași formulă moleculară și același număr de atomi de carbon asimetrici, care nu sunt enantiomeri, sunt între ei diastereoizomeri. De exemplu, D-glucoza și D-galactoza sunt diastereoizomeri (de exemplu, au 4 atomi de carbon asimetrici).
20.4. Structura monozaharidelor
Structură aciclică prezintă: triozele și tetrozele
Formă ciclică prezintă: monozaharide cu 5 atomi de carbon (pentoze), cu 6 atomi de carbon (hexoze) și mai mulți atomi de carbon. Această formă ciclică rezultă prin adiția unei grupe hidroxil la grupa carbonil unde se formează heterocatene ciclice de 5 sau 6 atomi.
Formele ciclice sunt mai stabile, comparativ cu cele aciclice. Structurile ciclice sunt în concordanță cu anumite proprietăți ale monozaharidelor care au fost observate experimental, cum ar fi:
- reactivitatea mare a unei grupe hidroxil comparativ cu celelalte grupe hidroxil din moleculă;
- lipsa reactivității monozaharidelor față de a anumiți reactivi specifici aldehidelor și cetonelor.
Printr-o adiție intramoleculară, glucoza adoptă o structură ciclică. Astfel, se obține o heterocatenă ciclică cu 6 atomi, în care unul este oxigenul. Ciclul format poartă denumirea de ciclu piranozic. Prin ciclizare apare o grupă hidroxil, denumită hidroxil glicozidic ce prezintă o reactivitate deosebită. În reacțiile de eterificare și esterificare această grupă este mai reactivă, comparativ cu restul grupelor hidroxil.
Structura piranozică a zaharidelor a fost descoperită în anul 1925 de către chimistul englez, Sir Walter Norman Haworth (1883 – 1950), pentru care a primit premiul Nobel pentru chimie în anul 1937.
După închiderea ciclului, raportat la hidroxilul din poziția 2 sau 4, orientarea hidroxilului glicozidic poate fi:
- de aceeași parte a catenei – în stereoizomerul α-glucoză;
- sau de cealaltă parte a catenei – în stereoizomerul β-glucoză;
α-glucoză și β-glucoză sunt 2 stereoizomeri care prin intermediul formei aciclice pot trece unul în celălalt. Aceștia se numesc anomeri. În soluție apoasă, anomerii α și β se transformă ușor unul în celălalt prin intermediul formei aciclice, cu stabilirea unui echilibru.
Prin dizolvarea în apă a α-D-glucopiranoză sau a β-D-glucopiranoză se obține o soluție care după stabilirea echilibrului prezintă următoarea compoziție:
- 36% anomer α;
- 64% anomer β;
- concentrația formei aciclice este extrem de mică.
Prin cristalizare din apă se poate obține anomerul α al D-glucozei, iar prin cristalizare din acid acetic anomerul β al D-glucozei.
Totodată, acest fenomen este însoțit de modificarea puterii rotatorii a soluției – denumit mutarotație. Astfel, soluția inițială de α-glucoză prezintă valoarea rotației specifice de +112°, iar soluția de β-glucoză de +19°. După atingerea echilibrului, rotația specifică a soluției devine +52,5°.
Prin ciclizare, atomul de carbon din grupa carbonil, devine asimetric.
Pentru reprezentarea structurilor ciclice ale monozaharidelor, se recomandă folosirea formulelor Haworth.
Reprezentarea catenei ciclice în aceste formule este sub forma unui hexagon orientat perpendicular pe planul foii, în care atomul de oxigen este dispus în poziție opusă privitorului. Celelalte două valențe ale atomului de carbon sunt orientate perpendicular pe acest plan, de o parte și de alta a acestuia. În formulele Haworth, pentru α-glucoză, hidroxilul glicozidic este de aceeași parte a planului ciclului cu hidroxilul din poziția 4 sau 2, iar pentru β-glucoză, aceștia de află de o parte și de alta a planului ciclului.
În plus, la scrierea formulelor Haworth se mai ține cont de următoarele aspecte:
- substituenții atomilor de carbon care în formula Fischer sunt de aceeași parte a catenei (spre dreapta), în formula Haworth se dispun de aceeași parte a planului (în partea de jos);
- excepție fac substituenții atomului de carbon din poziția 5 a cărui poziție este inversată.
Fructoza liberă prezintă ciclu piranozic rezultat prin adiția hidroxilului din poziția 6 la grupa carbonil.
Fructoza din di- sau polizaharide are ciclu furanozic care rezultă prin adiția hidroxilului din poziția 5 la grupa carbonil.
Denumirile ciclurilor monozaharidelor derivă de la piran și furan, două structuri organice care prezintă heterocatene ciclice cu un atom de oxigen. De exemplu, piranul are în ciclu 5 atomi de carbon și un atom de oxigen, iar furanul are 4 atomi de carbon și un atom de oxigen.
| Piran | Furan |
|---|---|
20.5. Proprietăți fizice ale monozaharidelor
Monozaharidele prezintă următoarele proprietăți fizice:
- sunt substanțe solide, cristalizate, incolore;
- prin încălzire avansată se descompun în: C și H2O;
- α-glucoza are p.t. de +146 °C;
- β-glucoza are p.t. de + 150 °C;
- sunt solubile în apă;
- sunt puțin solubile în alcool;
- sunt greu solubile în solvenți organici;
- au gust dulce – proprietate care se intensifică proporțional cu creșterea numărului de grupe de hidroxil în moleculă;
- prin grupele hidroxil conținute în moleculă, între monozaharide se pot stabili legături de hidrogen sau între acestea și moleculele de apă la dizolvarea lor în apă.
ACTIVITATE EXPERIMENTALĂ
Solubilitatea în apă și alcool a monozaharidelor
Reactivi și ustensile: glucoză solidă; apă distilată; alcool etilic; eprubete.
Mod de lucru: Experimental, solubilitatea în apă și alcool a glucozei poate fi determinată folosind două eprubete în care se introduce câte 1 g de glucoză solidă în fiecare dintre ele. În prima se adaugă 3-4 mL de apă distilată, iar în cea de a doua același volum de alcool etilic.
Observații: În acest fel se observă că monozaharidele sunt solubile în apă și puțin solubile în alcool.
20.6. Proprietățile chimice ale monozaharidelor
În formă aciclică, grupele hidroxil și grupa carbonil din moleculă, vor permite monozaharidelor să dea unele din reacțiile specifice acestor grupe funcționale. Deși forma aciclică se află în concentrație foarte mică în soluția unei monozaharide, consumarea ei în reacție determină deplasarea echilibrului în sensul formării ei și reacția poate continua.
Reacția de oxidare blândă a aldozelor
Condițiile de reacție pentru oxidarea blândă a aldozelor necesită:
- apă de brom sau apă de clor;
- reactiv Tollens;
- reactiv Fehling.
În molecula unei aldoze în formă aciclică, se găsește o grupă carbonil de tip aldehidă (–C=O) care este sensibilă față de agenții oxidanți și trece ușor în grupa carboxil (–COOH).
Aldozele sunt sensibile față de reactivii Tollens și Fehling. Reacții folosite pentru identificarea aldozelor.
Reacția de reducerea a reactivului Tollens cu glucoză a fost utilizat o perioadă lungă de timp în obținerea oglinzilor.
ACTIVITATE EXPERIMENTALĂ
Oxidarea cu reactivul Tollens a monozaharidelor
Reactivi și ustensile: soluție de glucoză 20%; reactivul Tollens; baie de apă; clește; eprubetă.
ACTIVITATE EXPERIMENTALĂ
Oxidarea glucozei cu reactivul Fehling
Reactivi și ustensile: soluție de glucoză 20%; reactivul Fehling; clește de lemn; eprubete.
Mod de lucru: Experimental, oxidarea reactivului Fehling poate fi observată folosind o eprubetă în care se aduc 2-3 mL de reactiv Fehling și se încălzește până la fierbere. Se continuă fierberea și se aduce soluție de glucoză 20-25% în picături în eprubetă până colorația albastră dispare complet și se obține un precipitat roșu-cărămiziu de oxid de cupru (I).
Observații: Aldozele reduc reactivul Fehling la oxid de cupru (I), precipitat roșu-cărămiziu.
Reacția de reducere
Condițiile de reacție pentru reducere necesită:
- H2, catalizator Ni;
- amalgam de Na și acid.
Reducerea grupei carbonil din aldoze sau cetoze, cu hidrogen molecular în prezență de nichel sau cu amalgam de sodiu și acid, rezultă alcooli polihidroxilici. Hexozele dau prin reducere hexitoli.
Prin reducerea cetozelor, atomul de carbon din grupa carbonil devine asimetric și astfel rezultă doi alditoli izomeri care diferă între ei prin configurația acestui atom de carbon.
| D-sorbitol | D-manitol |
|---|---|
| se întâlnește în numeroase fructe; cel mai mult în sorbul de munte (Sorbus aucuparia) | este mult răspândit în natură |
| în industrie se obține prin hidrogenarea glucozei | în timpul verii, anumite alge marine brune prezintă un conținut de până la 37% din masa uscată de D-manitol |
| este materia primă pentru sinteza vitaminei C | este folosit pentru obținerea rășinilor de tip gliptal și a uleiurilor sicative sintetice |
Reacția cu metanolul în prezență de acid clorhidric
Hidroxilul glicozidic din molecula unei monohazaride poate să treacă în eter, în urma reacției cu metanolul și în prezență de acid clorhidric. În aceste condiții, celelalte grupe hidroxil fiind mai puțin reactive, nu vor reacționa.
Reacția cu iodură de metil în prezență de oxid de argint
În urma reacției cu iodură de metil în prezență de oxid de argint, are loc trecerea în eteri și a celorlalte grupări hidroxil.
20.7. Glucoza (C6H12O6)
Caracteristicile glucozei:
- cea mai răspândită monozaharidă;
- este o aldohexoză;
- se află în concentrații mari în fructele dulci, mierea de albine;
- este prezentă în sânge în concentrații de 0,06-0,10%; precum și în concentrații mici în limfă, LCR (lichid cefalorahidian), etc.;
- se pot face administrări de glucoză perfuzabilă la nevoie;
- intră în alcătuirea a numeroase oligozaharide și polizaharide; cele mai importante sunt: zaharoza, celuloza și amidonul;
- are 75% din puterea de îndulcire a fructozei care este considerată ca unitate (1).
Proprietăți fizice ale glucozei:
- substanță solidă, cristalizată, incoloră;
- solubilă în apă;
- greu solubilă în solvenți organici;
- p.t. = 167 °C;
- poate exista sub două forme: α-glucoză și β-glucoză; diferența dintre ele este dată de poziția în spațiu a unei grupe –OH.
Acțiunea biologică:
- constituie sursa de energie (combustibilul) specifică creierului și sistemului nervos;
- furnizează energie care intervine în menținerea temperaturii constante a corpului, contracția mușchilor, precum și funcționarea sistemelor digestiv și respirator;
- este important de menținut în sânge concentrația de glucoză în intervalul 0,06-0,11% astfel încât să asigure o distribuție continuă de energie pentru creier, mușchi, nervi și alte sisteme din corp;
- o scădere a concentrației sub limita minimă duce la diminuarea funcționării creierului;
- o concentrație de 0,16% de glucoză în sânge permite trecerea glucozei în urină pe calea rinichilor și permite astfel instalarea unuia dintre simptomele diabetului zaharat.
Utilizări:
- în medicină – compus ușor asimilabil în organism și un bun furnizor de energie (glucoza perfuzabilă); pentru hrănirea artificială a unor bolnavi;
- în industrie – pentru prepararea produselor zaharoase, a gluconatului de calciu, a pastilelor cu vitamina C;
- în alimentație ca îndulcitor al zahărului;
- în industria textilă – la imprimarea țesăturilor;
- la fabricarea oglinzilor.
Proprietăți chimice:
- are caracter reducător – reduce ionii de Ag+ la Ag metalic (astfel se folosește la argintarea oglinzilor);
- fermentează în prezența unor enzime din drojdia de bere – se obține alcool etilic și CO2; în acest fel de obțin băuturile alcoolice prin fermentarea sucurilor dulci de fructe;
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

