12. Acizi carboxilici
Cuprins:
12.1. Definiție și denumire12.2. Utilizările și structurile plane ale unor acizi carboxilici
12.3. Acidul acetic
12.4. Reacții de obținere
12.5. Proprietăți chimice
12.6. Alți acizi carboxilici
12.7. Săpunuri și detergenți
12.8. Grăsimi
12.9. Ceruri
12.1. Definiție și denumire
Acizii carboxilici sunt compuși organici care prezintă în moleculă grupa funcțională carboxil, –COOH, legată de un radical hidrocarbonat. Totodată, acizii sunt derivați monofuncționali ai hidrocarburilor în molecula cărora se află una sau mai multe grupa carboxil, –COOH.
Formula generală: R–COOH
Pentru denumirea acizilor carboxilici se folosește cuvântul „acid” urmat de numele hidrocarburii cu același număr de atomi de carbon, la care se adaugă sufixul „-oic”.
Exemple de acizi carboxilici:
| Acid metanoic (denumire uzuală: acid formic) | Acid etanoic (denumire uzuală: acid acetic) | Acid propanoic |
|---|---|---|
| H–COOH | CH3–COOH | CH3–CH2–COOH |
Pentru acizii care prezintă în moleculă catene ramificate sau alți substituenți, în alcătuirea numelui este necesar să se precizeze și poziția acestora. Astfel, se numerotează atomii de carbon din catena de bază, începând cu atomul de carbon din gruparea –COOH.
Exemple:
| Acid 2-metilpropanoic | Acid 2-etilbutanoic |
|---|---|
12.2. Utilizările și structurile plane ale unor acizi carboxilici
Utilizările și formulele plane ale unor acizi carboxilici:
| Denumire acid | Formula acidului | Utilizări |
|---|---|---|
| Acid metanoic (acid formic) | HCOOH | în tăbăcărie la decalcificarea pieilor; ca mordant (mordant = substanță chimică ce fixează coloranții pe fibrele textile) în industria textilă |
| Acid benzoic | intră în compoziția unor rășini vegetale, cum ar fi smirnă, tămâie; ca expectorant și antiseptic în medicină; ca și conservant alimentar; la obținerea unor coloranți | |
| Acid ftalic (acid 1,2-benzendicarboxilic) | în industria coloranților; la obținerea plastifianților; la obținerea rășinilor pentru lacuri | |
| Acid tereftalic (acid 1,4-benzendicarboxilic) | ca materie primă pentru fabricarea PET (polietilentereftalat) din care rezultă fibre sintetice și ambalaje | |
| Acid citric | larg distribuit în natură; se întâlnește în fructe (coacăze, zmeură), sfeclă, leguminoase și în citrice în cantitate mare; este utilizat în industria alimentară și în cosmetică; printre alți acizi, se găsește în mod natural în vin | |
| Acid tartric | printre alți acizi, se găsește în mod natural în vin | |
| Acid malic | printre alți acizi, se găsește în mod natural în vin | |
| Acid lactic | printre alți acizi, se găsește în mod natural în vin |
12.3. Acidul acetic
Soluția de acid acetic diluată în concentrație de 3-9% reprezintă oțetul utilizat în alimentație. Acidul acetic este folosit pentru obținerea:
- anumitor medicamente;
- mătăsii acetat;
- unor esteri;
- unor materiale plastice și adezivi (cum ar fi poliacetat de vinil);
- unor coloranți;
- etc.
Fermentația acetică
Etanolul se obține prin fermentație alcoolică, însă acest proces nu se oprește doar stadiu de alcool. În condiții normale (adică nu se adaugă substanțe chimice) și în contact cu aerul, vinul natural îți continuă procesul de fermentație, modificându-și proprietățile de gust, miros, aciditate. După un anumit interval de timp se remarcă practic transformarea vinului în oțet, proces care poartă numele de oțetirea vinului.
ACTIVITATE EXPERIMENTALĂ
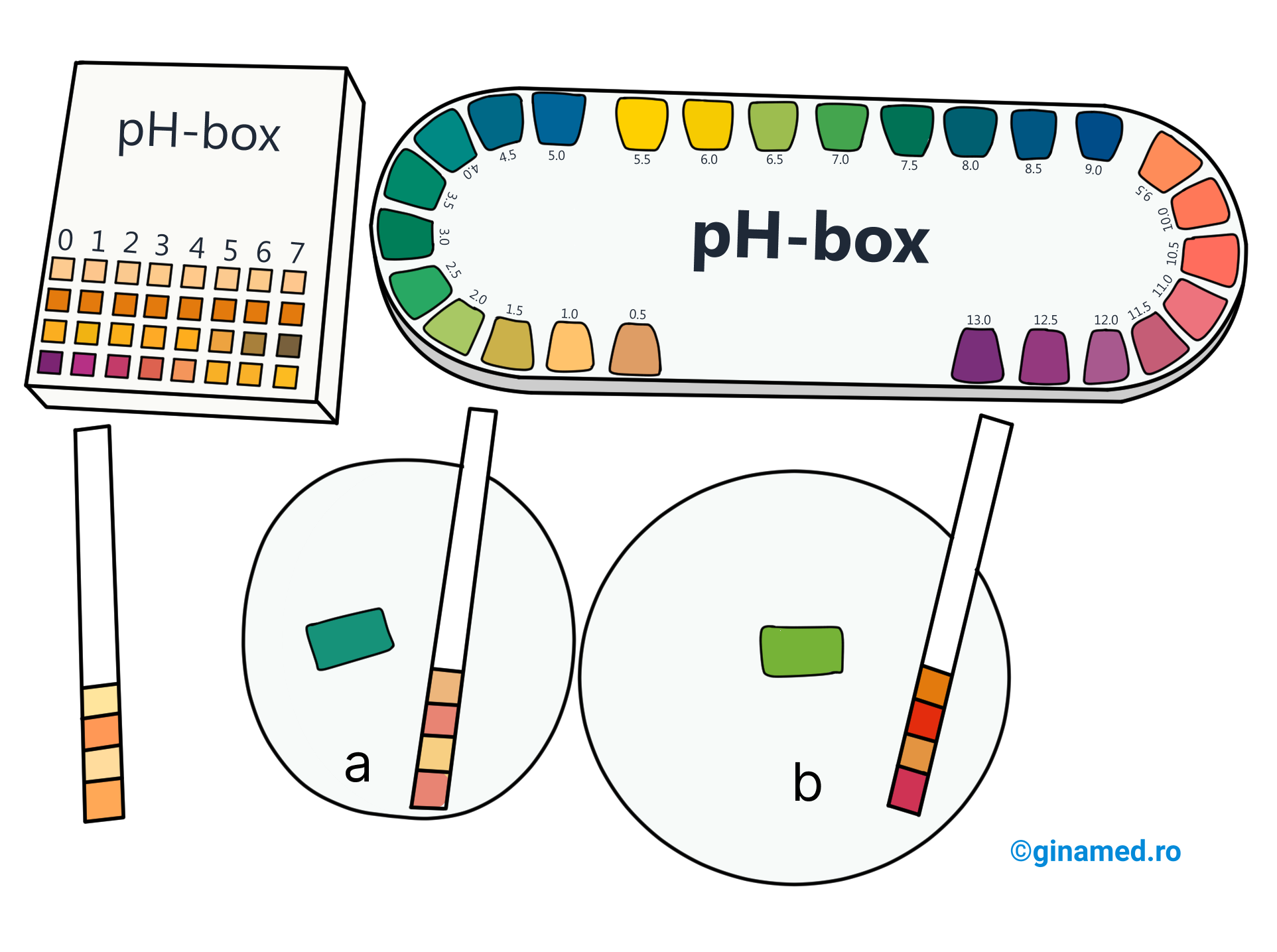
Mod de lucru: Într-un pahar sau într-o sticluță se aduc 50-100 mL de vin alb și se măsoară pH-ul. Se acoperă paharul cu o hârtie. O dată sau de două ori pe săptămână, se măsoară pH-ul vinului din pahar și se notează rezultatele într-un tabel. Experimentul se consideră terminat când rezultatul măsurătorilor indică valori de pH < 3.
Se măsoară și pH-ul oțetului alimentar din comerț. Se miroase vinul din pahar și oțetul. Se compară toate rezultatele și se emite o concluzie.
Observații: În timp, pH-ul probei de vin scade. În final, valoarea pH-ului vinului se apropie sau devine chiar egală cu cea a pH-ului oțetului. În final, proba din pahar miroase a oțet, pentru că vinul a continuat să fermenteze, schimbându-și printre altele și aciditatea. Practic, a avut loc procesul de oțetirea vinului.
Deci valoarea pH-ului poate fi un indicator al calității alimentelor. De exemplu, laptele proaspăt are un pH ușor bazic, pe când laptele mai vechi care a început să se acrească, prezintă pH acid.
Un lichid cu un conținut de etanol, cum este de exemplu, vinul, dacă este lăsat în contact cu aerul, este supus acțiunii unor bacterii (Micoderma aceti) care există în aer. Acestea produc o enzimă, alcooloxidaza, care catalizează oxidarea etanolului la acid acetic.
Procesul de transformare enzimatică a etanolului în acid acetic poartă numele de fermentație acetică.
Acidul acetic de uz alimentar se obține doar prin fermentația enzimatică a etanolului din vin. Denumirea sub care este comercializat este de oțet de vin.
Acidul acetic poate fi obținut și pe cale industrială din materii prime fabricate tot prin metode de sinteză chimică. Acidul acetic obținut pe cale industrială este toxic pentru organism deoarece conține și alte impurități (produși secundari de reacție). De aceea, comercializarea sa ca oțet alimentar este interzisă.
Proprietățile fizice ale acidului acetic anhidru, denumit și acid acetic glacial, sunt:
- este un lichid incolor,
- prezintă miros înțepător, specific acizilor;
- punctele de fierbere și de topire sunt ridicate; din acest motiv este volatil la temperatura camerei și poate trece în stare solidă (cristalizează) la temperaturi de 16,5°C; punctul său de fierbere este la 118°C;
- acidul acetic este foarte ușor solubil în apă; formarea de legături de hidrogen cu apa îi permite formarea unui amestec omogen cu aceasta în orice proporție.
12.4. Reacții de obținere
Oxidarea alcanilor superiori
În prezența unor catalizatori, alcanii superiori (parafina) se oxidează (cu sau fără ruperea moleculei), rezultând acizi carboxilici superiori (cu număr mare de atomi de carbon, acizi grași) folosiți la fabricarea săpunurilor.
Oxidarea energică a alchenelor
Oxidarea energică a alchenelor se face cu:
- K2Cr2O7 în H2SO4 sau
- KMnO4 în H2SO4.
În urma acțiunii agenților oxidanți, legătura dublă C = C se rupe și se obțin amestecuri de diferiți produși de oxidare, în funcție de structura inițială a alchenei, astfel: atunci când atomul de C implicat în legătura dublă conține hidrogen, rezultă un acid carboxilic: R–COOH. Situațiile în care se pot obține acizi carboxilici prin oxidarea energică a alchenelor:
Oxidarea la catena laterală
Oxidarea catenei laterale (alchil) legată de un atom de carbon dintr-un nucleu aromatic, se desfășoară în prezența:
- agenților oxidanți sau
- a oxigenului molecular și catalizatori;
În situația în care nucleul aromatic este substituit cu două grupe alchil, fiecare dintre acestea se va oxida.
Dintre toți acizii rezultați prin oxidarea xilenilor (acid ftalic, izoftalic, tereftalic), numai acidul ftalic permite formarea de anhidridă deoarece cele două grupări carboxilice sunt apropiate și favorizează închiderea unui ciclu stabil de 5 atomi.
Indiferent de lungimea catenei laterale, radicalii alchil conținuți de aceasta, sunt oxidați la acizi în care grupa carboxil –COOH este legată direct de atomi de carbon care fac parte din nucleul aromatic.
În cazul în care poziția benzilică a catenei laterale nu prezintă hidrogen atunci oxidarea cu agenți oxidanți nu poate să aibă loc. Oxidarea catenei laterale a alchilbenzenilor prezintă importanță în anumite procese metabolice.
Oxidarea energică a alcoolilor primari (cu KMnO4/H2SO4)
Oxidarea aldehidelor
Aldehidele, față de cetone, se pot oxida la acizi carboxilici și pot reduce reactivii Tollens și Fehling.
Reacțiile anhidridei acide cu alcool, fenol, amină primară, amoniac
Hidroliza derivaților trihalogenați geminali
Condiții de reacție pentru hidroliza derivaților halogenați: soluție apoasă de baze tari (NaOH, KOH).
Fermentația acetică enzimatică (oțetirea vinului)
Sinteza Kolbe (carboxilarea fenolaților)
Reacții din cadrul sintezei Kolbe conduc la obținerea acidului salicilic:
Hidroliza derivaților funcționali ai acizilor
Hidroliza esterilor
Hidroliza grăsimilor (sunt tot esteri)
Hidroliza halogenurilor acide
Hidroliza anhidridelor acide
Hidroliza amidelor
Hidroliza nitrililor
12.5. Proprietăți chimice
Acizii carboxilici prezintă în moleculă grupa carboxil, –COOH și un radical hidrocarbonat, care ambele influențează proprietățile chimice ale acestora.
Structura grupei carboxil
Datorită structurii grupei funcționale carboxil și a prezenței acestora în moleculele acizilor carboxilici, le imprimă acestora proprietăți fizice și chimice caracteristice acestei clase de compuși organici.
Astfel, în structura grupei carboxil intră 2 atomi de oxigen legați de același atom de carbon:
- unul prin intermediul unei legături duble, –C=O;
- celălalt atom prin intermediul unei legături simple, –C–O–H, deoarece face parte din grupa hidroxil, –O–H;
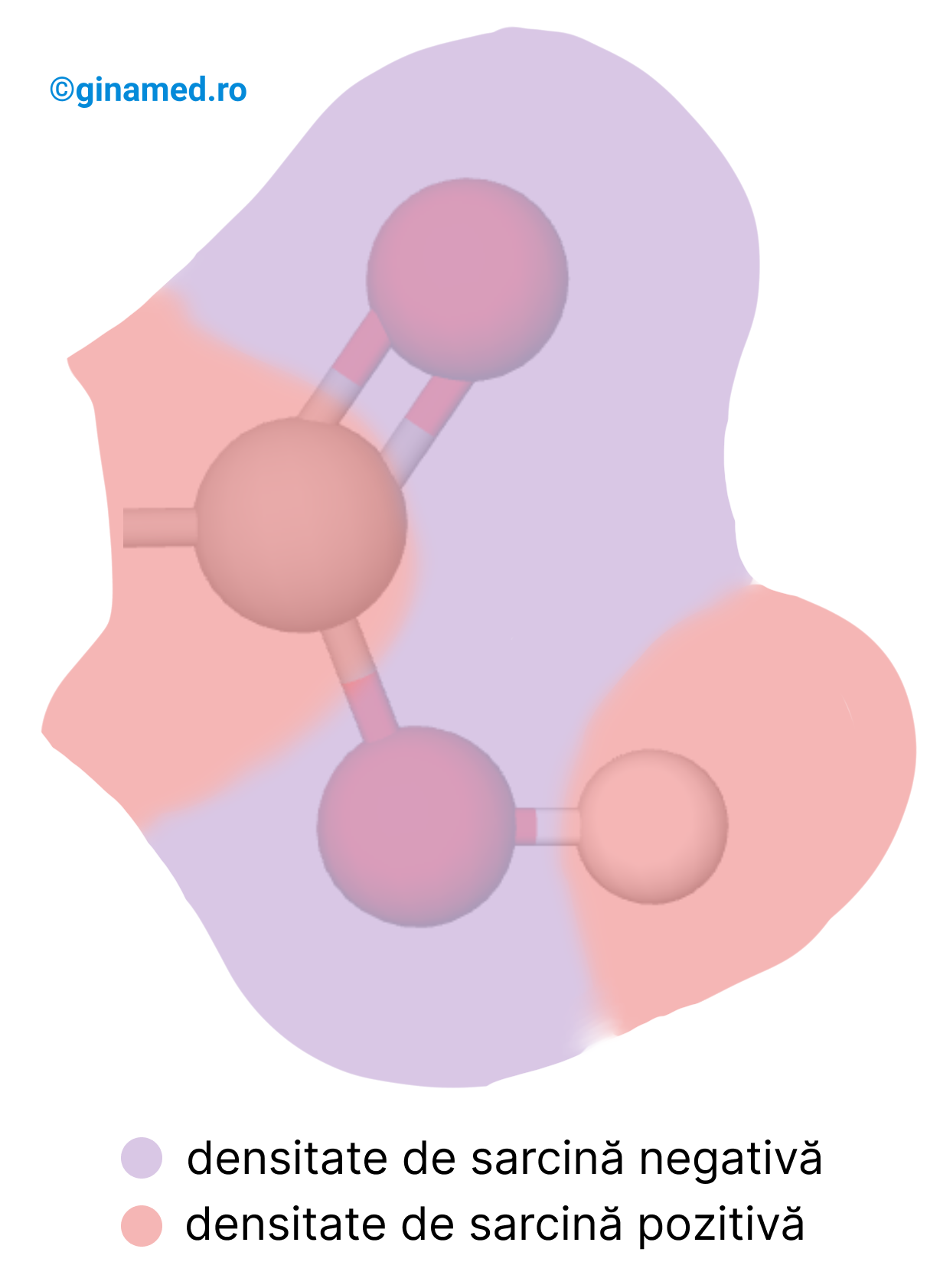
În grupa carboxil, –COOH, se formează un orbital π extins prin întrepătrunderea laterală a orbitalului p al atomului de carbon cu un orbital p monoelectronic al atomului de oxigen dublu legat și cu un orbital hibrid dielectric al atomului de oxigen din grupa hidroxil, –OH.
Aceste aspecte structurale conferă compușilor carboxilici un caracter acid mai pronunțat comparativ cu cel al fenolilor.
Caracterul acid
- polaritatea legăturii hidrogen-nemetal;
- labilitatea hidrogen-nemetal;
- stabilitatea anionului (A-).
Cu cât un acid este mai tare (cedează mai ușor protoni), cu atât baza conjugată a acestuia este mai slabă (acceptă mai greu protoni) și invers.
Prin reacția unui acid cu o bază conjugată a unui acid mai slab decât el, se pune în libertate acidul mai slab.
Valorile constantei de aciditate și a exponentului de aciditate pentru anumiți compuși:
| Compus | Valoare ka (mol/L) | Valoare pka |
|---|---|---|
| CH3–COOH | 1,8 ∙ 10-5 | 4,75 |
| H2CO3 | 4,3 ∙ 10-7 | 6,37 |
| HCO3- | 4,8 ∙ 10-11 | 10,32 |
| HCl | 107 | -7 |
| C6H5–OH | 1,3 ∙ 10-10 | 9,9 |
Conform valorilor de mai sus, următoarele reacții NU AU LOC:
- CH3–COONa + H2CO3; Explicație: acidul acetic este un acid mai tare decât acidul carbonic și nu poate fi scos din sarea sa de un acid mai slab decât el.
- CH3–COOH + NaCl; Explicație: acidul clorhidric este un acid mai tare decât acidul acetic și nu poate fi scos din sarea sa de un acid mai slab decât el.
- CH3–COONa + C6H5–OH; Explicație: acidul acetic este un acid mai tare decât fenolul și nu poate fi scos din sarea sa de un acid mai slab decât el.
Acizii carboxilici sunt acizi mai slabi decât acizii minerali, însă sunt mai tari decât acidul carbonic și fenolii.
"Dizolvarea" acizilor carboxilici în soluții apoase de carbonați acizi alcalini (denumiți uzual, bicarbonați) constituie reacția de recunoaștere a acizilor carboxilici.
| Acid carboxilic | Structură | Valoare ka (mol/L) | Valoare pka |
|---|---|---|---|
| acid acetic | CH3–COOH | 1,8 ∙ 10-5 | 4,74 |
| acid propanoic | CH3–CH2–COOH | 1,33 ∙ 10-5 | 4,87 |
| acid cloroacetic | Cl–CH2–COOH | 155 ∙ 10-5 | 2,86 |
| acid benzoic | 6,3 ∙ 10-5 | 4,2 | |
| acid p-metilbenzoic | 4,2 ∙ 10-5 | 4,38 | |
| acid p-clorobenzoic | 10,3 ∙ 10-5 | 3,97 | |
| acid p-nitrobenzoic | 36 ∙ 10-5 | 3,42 |
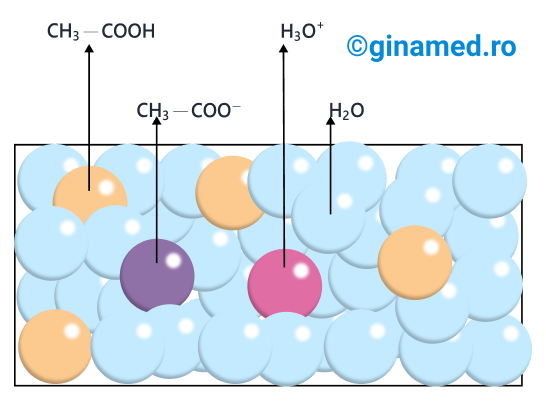
Reacția acidului acetic cu apa
Acidul acetic stabilește legături de hidrogen cu apa și astfel, acidul acetic se dizolvă în apă. În soluție apoasă, un anumit număr de molecule de acid acetic ionizează (practic, în soluție apoasă, acizii carboxilici ionizează parțial). Ionii care apar în soluție pot să reacționeze și ei, cu scopul de a reface acidul acetic.
În soluția apoasă de acid acetic se întâlnesc (în stare hidratată):
- molecule de acid acetic, CH3–COOH și
- ioni acetat, CH3–COO- și
- ioni hidroniu, H3O+.
ACTIVITATE EXPERIMENTALĂ
Caracterul acid
Observații: În toate cele 3 pahare, soluțiile s-au colorat în roșu, de intensități diferite.
Completare: Variațiile de culoare ale indicatorilor acido-bazici în mediu acid și bazic.
| Indicator acido-bazic | Mediu ACID | Mediu BAZIC |
|---|---|---|
| METILORANJ | roșu (pH=3,1) | galben (pH=4,4) |
| ROȘU DE METIL | roșu | galben |
| TURNESOL | roșu | albastru |
Prin dizolvarea acizilor în apă se formează soluții cu caracter acid. În funcție de culoarea indicatorului acido-bazic se obțin informații calitative referitoare la puterea sau forța acizilor. De exemplu, în urma experimentului de mai sus, culoarea indicatorului de pH este cea mai intensă în cazul soluției de acid clorhidric, apoi mai puțin intensă pentru soluția de acid acetic și apoi scade în intensitate pentru apa carbogazoasă. Astfel, acidul acetic este un acid mai puternic decât apa carbogazoasă (acidul carbonic), însă ambii sunt încadrați ca fiind acizi slabi, mai puțin puternici (mai slabi) comparativ cu acidul clorhidric, care face parte din clasa acizilor tari.
Cunoașterea valorii constantei de aciditate permite următoarele:
- aprecierea tăriei acidului;
- compararea acidului cu alți acizi;
- calcularea concentrației de ioni hidroniu dintr-o soluție de acid, etc.
Problemă rezolvată
Caracterul acid al acidului acetic se manifestă în reacțiile acestuia cu:
- apa;
- metale active;
- oxizi de metale;
- hidroxizi și săruri ale unor acizi mai slabi decât acidul acetic (cum ar fi carbonații).
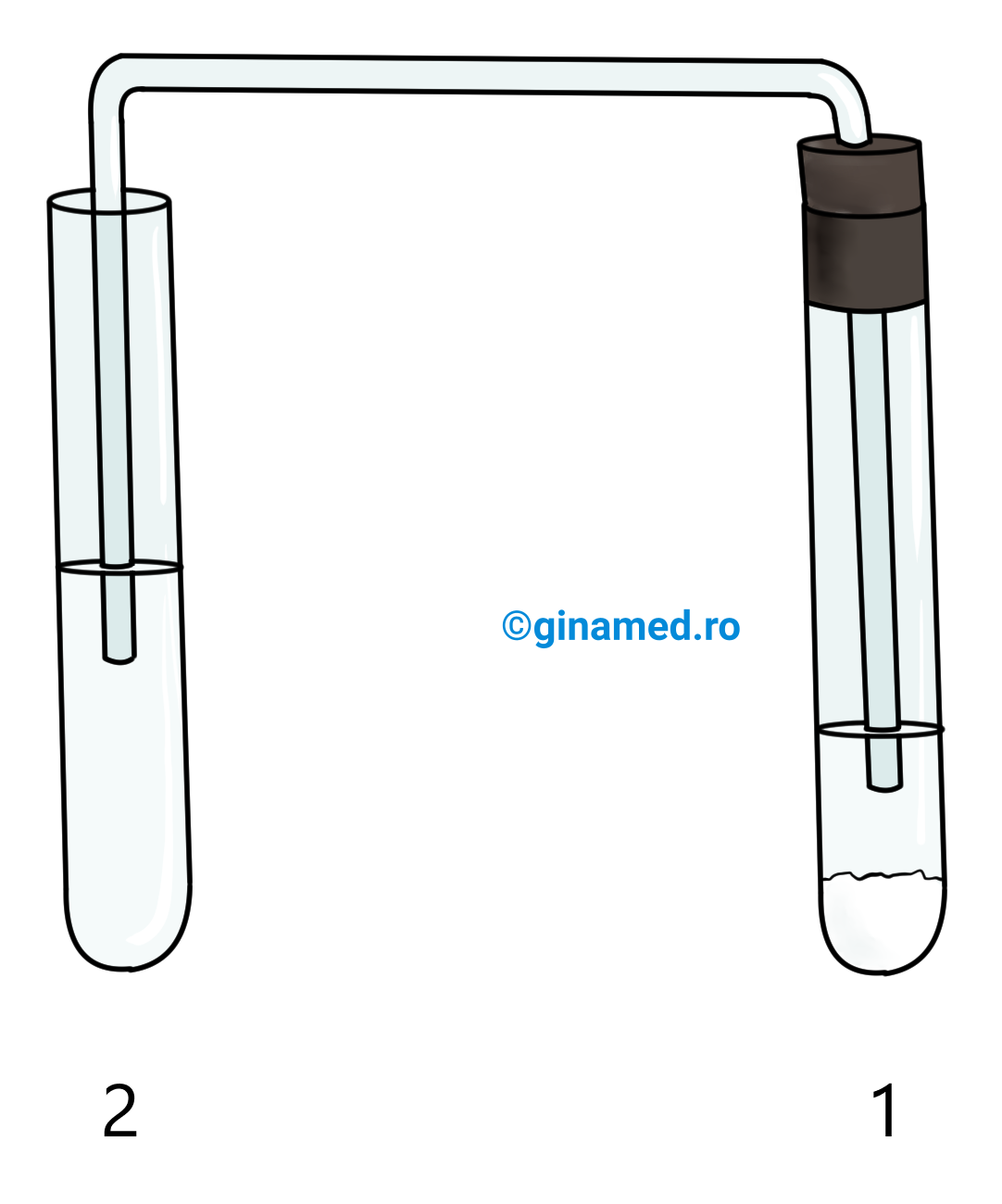
ACTIVITATE EXPERIMENTALĂ
Reacția acidului acetic cu metale active
Mod de lucru: Sunt necesare 6 eprubete numerotate. În primele 4 eprubete se aduc câte unul dintre metalele: magneziu (Mg), fier (Fe), zinc (Zn) și cupru (Cu). În ultimele două eprubete (5 și 6) se aduce puțin oxid de calciu CaO (sau var nestins). În eprubetele 1 – 5 se pun aproximativ 5 mL de soluție de acid acetic 10%, iar în eprubeta 6 doar apă.
Observații: Se observă cum în eprubetele 1 – 3, cele care conține Mg, Fe și Zn, se desfășoară reacții care duc la degajarea unui gaz. În eprubeta 4 în care se află Cu, nu are loc nicio reacție. În eprubeta 5, în care se află acid acetic și CaO, a avut loc o reacție chimică în urmă căreia a rezultat o soluție limpede. În eprubeta 6, în care se află doar apă și CaO, a rezultat un precipitat alb. Mai multe explicații pentru observațiile din experiment vor fi date mai jos, la reacția cu metale active.
Reacția cu metale active
Sărurile acidului acetic se numesc acetați, dintre care majoritatea sunt solubili în apă.
Acidul acetic poate reacționa cu pulbere de aluminiu proaspăt preparată conducând la obținerea acetatului de aluminiu, substanță cunoascută în medicină cu numele de "apă de Burow".
Reacția cu oxizi ai metalelor
Acizii carboxilici inferiori lichizi, anhidri sau în soluție apoasă reacționează cu oxizii bazici (oxizii bazici sunt oxizi ai metalelor care reacționează cu acizii).
Acidul acetic intră în reacție cu oxizii metalelor, formând sarea corespunzătoare și apă.
Reacția cu hidroxizi ai metalelor
Acidul acetic intră în reacție cu hidroxizii, formând acetatul corespunzător și apă. Are loc o reacție de neutralizare.
Prin reacția acidului acetic cu hidroxizii alcalini (hidroxid de sodiu (NaOH), hidroxid de potasiu (KOH)) rezultă acetații alcalini corespunzători. Acești compuși sunt ușor solubili în apă.
Acizii carboxilici inferiori lichizi, anhidri sau în soluție apoasă reacționează cu bazele insolubile.
Acizii organici, lichizi sau solizi, solubili sau insolubili în apă, reacționează cu soluțiile apoase ale hidroxizilor alcalini cu formare de săruri solubile.
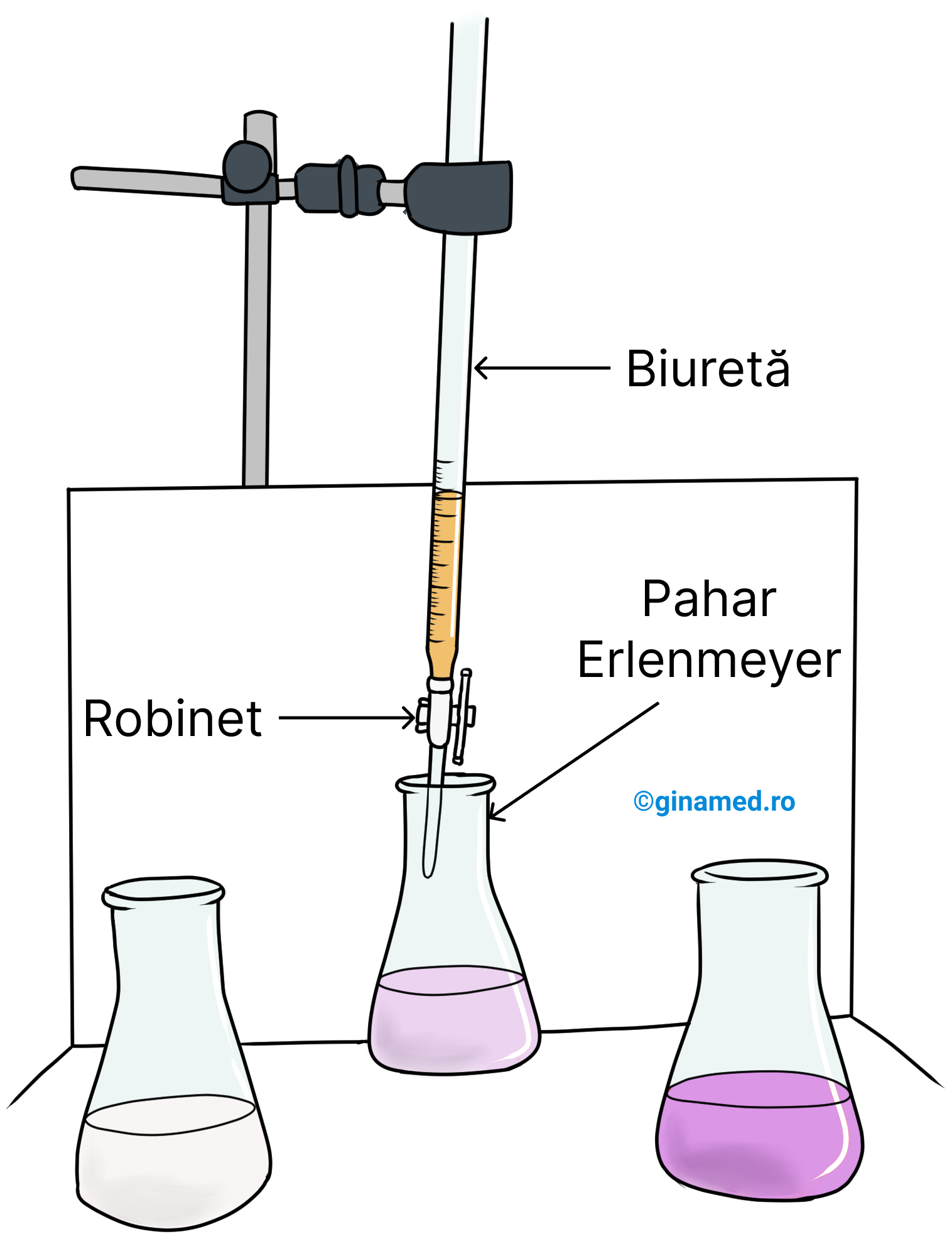
Reacțiile de neutralizarea stau la baza metodelor de determinare cantitativă prin titrimetrie (volumetrie) care se bazează pe reacții acido-bazice.
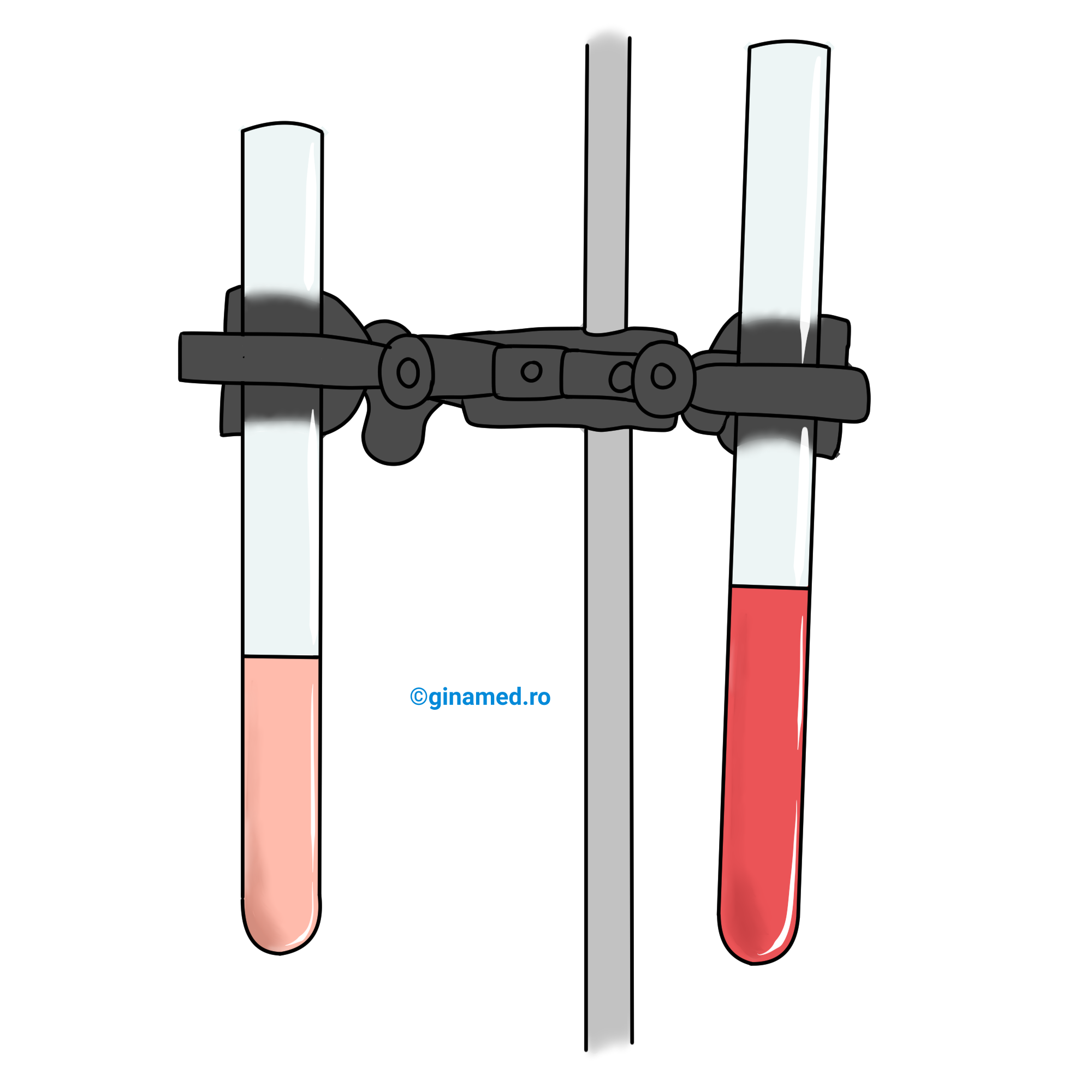
Determinarea cantitativă a acidului acetic se poate face prin titrare cu o soluție de bază tare (NaOH sau KOH) de concentrație cunoscută, în prezența fenolftaleinei ca indicator acido-bazic, folosind o instalație precum în imaginea de mai jos.
Problemă rezolvată
Calculează ce volum de soluție de NaOH 1 M este necesar pentru a neutraliza 10 mL de soluție de acid acetic 0,5 M.
Rezolvare:
Se scrie ecuația reacției chimice:
X = 5 moli NaOH
Reacția cu carbonați
ACTIVITATE EXPERIMENTALĂ
Reacția de esterificare
Reacția dintre un acid și un alcool în urma căreia se elimină o moleculă de apă și se formează un ester, poartă numele de reacție de esterificare. Reacția de esterificare este o reacție de substituție.
După cum se observă mai sus, reacția este reversibilă (adică are loc și în sens opus) și anume, acetatul de etil format poate să reacționeze cu apa rezultată din reacție, refăcând astfel reactivii.
De la stânga la dreapta sau în sensul „→”, este reacția de esterificare.
De la dreapta la stânga sau în sensul „←”, este reacția de hidroliză.
Conform experimentelor, în amestecul inițial de reactivi se găsesc: 1 mol de acid acetic și 1 mol de alcool etilic. Reacțiile sunt reversibile (se desfășoară în ambele sensuri) până când în vasul de reacție se găsesc:
- 0,33 moli de acid acetic;
- 0,33 moli de alcool etilic;
- 0,66 moli de acetat de etil;
- 0,66 moli de apă.
În acest moment se poate afirma că starea de echilibru a fost atinsă (adică concentrațiile tuturor substanțelor din sistem rămân constante).
În cazul în care se pornește de la un amestec echimolar (același număr de moli) de acid acetic și etanol, compoziția amestecului de reacție la echilibru este întotdeauna aceeași, și anume:
- 1/3 moli acid;
- 1/3 moli etanol;
- 2/3 moli acetat de etil;
- 2/3 moli de apă.
Sistemul de reacție poate fi scos din starea de echilibru sau poate permite desfășurarea reacției în sensul în care se obține ester, prin două posibilități:
- unul dintre reactivi este folosit în exces; în general este vorba despre alcool, de exemplu etanolul;
- unul dintre produși este scos din vasul de reacție, pe măsură ce acesta se formează; în general se elimină prin distilare produsul cel mai volatil, care este esterul.
Totodată, reacția de esterificare dintre o moleculă de acid acetic și o moleculă de etanol, cu eliminarea unei molecule de apă, este un exemplu de reacție de condensare.
Atunci când în reacțiile de esterificare sunt implicate molecule de acizi dicarboxilic și de dioli sau trioli, se desfășoară reacții de policondensare (cu alte cuvinte, reacții de polimerizare prin reacții de condensare). Produșii rezultați sunt poliesteri care constituie polimeri de condensare. Aceștia sunt utilizați ca fire și fibre sintetice.
Denumirea esterilor
Denumirea esterilor se realizează asemănător cu cea pentru săruri și anume: sufixul „-oic” sau „-ic” din numele acidului, se înlocuiește cu sufixul „-at”, la care se adaugă prepoziția „de”, urmată de numele radicalului hidrocarbonat din alcool.
De exemplu: etanoat de etil sau acetat de etil.
Similar multor altor esteri, acetatul de etil prezintă un miros plăcut. Esterii intră în compoziția mai multor compuși naturali. Prin prezența lor își aduc contribuția la aroma fructelor și parfumul florilor.
În natură, esterii se întâlnesc sub formă de grăsimi și uleiuri. Acestea două din urmă sunt esteri ai glicerinei cu acizi grași.
Reacția cu PCl5
Cele două reacții de mai sus se folosesc pentru obținerea clorurilor acide și a anhidridelor acide.
Reacția de nitrare
Pentru compușii aromatici care prezintă grefat pe nucleul aromatic substituenți, orientarea și condițiile reacției de nitrare sunt dependente de natura substituentului.
Produșii de nitrare ai compușilor aromatici se folosesc pentru obținerea aminelor aromatice, a intermediarilor în sinteza coloranților, a explozivilor și multe altele.
Reacția cu fenoxizi
Reacția acidului acetic cu clorul molecular în prezența luminii
Reacția acizilor carboxilici cu amoniacul (completare)
12.6. Alți acizi carboxilici
Acizi grași
Acizii grași sunt acizi carboxilici cu catenă liniară alcătuită dintr-un număr par de atomi de carbon (n ≥ 4).
În funcție de natura catenei sau a radicalului hidrocarbonat, acizii grași se clasifică în:
- acizi grași saturați – au doar legături simple, σ, între atomii de carbon vecini; formula moleculară generală a acestora este: CH3–(CH2)n–COOH;
- acizi grași nesaturați – conțin în moleculă cel puțin o legătură dublă, C=C, pe lângă legăturile simple, σ.
În principal, acizii grași se întâlnesc sub formă de esteri cu glicerina, în grăsimi și uleiuri (materii organice grase). Acizii grași pot intra în compoziția unor produse naturale de origine animală și vegetală, cum ar fi acidul butanoic și acidul stearic (ambii sunt acizi grași saturați).
Acizi grași saturați
Acizii grași saturați se întâlnesc în majoritate în grăsimile de origine animală, printre care se numără:
- acid butanoic (acid butiric): CH3–CH2–CH2–COOH sau scris restrâns CH3–(CH2)2–COOH; prezintă în moleculă 4 atomi de carbon și este primul acid din seria acizilor grași; intră în compoziția untului din lapte de vacă.
- acid capronic (n = 6), acid caprilic (n = 8) și acid caprinic (n = 10); toți acești acizi intră în compoziția untului din lapte de capră;
- acid lauric: CH3–(CH2)10–COOH; n = 12; se întâlnește predominant în untul de origine vegetală obținut din laptele din nuca de cocos;
- acidul palmitic: CH3–(CH2)14–COOH; n = 16;
- acidul stearic: CH3–(CH2)16–COOH; n = 18; atât acidul palmitic cât și stearicul reprezintă constituenți principali ai grăsimii din corpurile animalelor.
Acizi grași nesaturați
Acizii grași nesaturați intră în alcătuirea uleiurilor extrase din semințele sau fructele unor plante. Printre aceștia se numără:
- acidul oleic cu n = 18 și o legătură dublă C=C în moleculă; prezintă formula structurală plană: CH3–(CH2)7–CH=CH–(CH2)7–COOH; reprezintă constituentul principal, în forma cis, a grăsimii din untul de cacao și din unele uleiuri;
- acidul linoleic cu n = 18 și cu 3 duble legături C=C (Completare: în unele ediții ale manualului apare că ar avea 2 legături duble; corect ar fi cu 2 duble legături); intră în alcătuirea esterilor care se întâlnesc în uleiuri vegetale de soia, porumb.
Săpunurile sunt produse indispensabile pentru igiena și sănătatea oamenilor, iar în alcătuirea acestora intră acizi grași. Astfel, există o cerere mondială crescută de acizi grași proporțional cu dezvoltarea societății omenești și cu creșterea nivelului de civilizație.
Pornind de la compuși prezenți în natură, acizii grași pot fi obținuți astfel:
- din grăsimi (esteri ai acizilor grași cu glicerina), prin reacția de hidroliză;
- din parafină, prin oxidarea catalitică a acesteia.
Într-un procent foarte mic (< 1%), acizii grași intră în compoziția petrolului. Aceștia rezultă din prelucrarea cu hidroxid de sodiu (NaOH) a unor fracțiuni petroliere. Aceștia sunt constituenți ai acizilor naftenici (Completare: acizii naftenici sunt amestecuri de mai mulți acizi ciclohexil și ciclopentil carboxilici) și au fost descoperiți de către Markovnikov în anul 1892. Abia în anul 1938 structura acestor acizi a fost stabilită de către C. D. Nenițescu și D. Isăcescu.
12.7. Săpunuri și detergenți
Aplicabilitatea practică a săpunurilor și detergenților se rezumă la îndepărtarea petelor grase și a murdăriei din țesuturi și de pe piele, păr, etc., pe care le adună și le duc în apă de spălare.
Gradul de civilizație al unei populații dintr-o comunitate umană este apreciat prin consumul de săpun pe cap de locuitor, folosit ca un indicator.
Regula „Cine se aseamănă se dizolvă” este reprezentată practic prin săpunuri și detergenți. Cu alte cuvinte, substanțele se dizolvă în solvenți care prezintă structură asemănătoare.
Săpunurile și detergenții sunt încadrate în clase de compuși organici diferite, însă moleculele acestora prezintă aceleași două părți componente caracteristice:
- coada – o catenă (un radical hidrocarbonat) lungă și
- cap – o grupă funcțională prezentă la o extremitate a cozii.
Săpunuri
Săpunurile reprezintă săruri de sodiu sau de potasiu, calciu ale acizilor grași. Fabricarea săpunurilor a fost cunoscută în Italia și Spania în secolul al VIII-lea. La acel moment săpunul era obținut din grăsimi animale și un praf preluat din coaja unui anumit copac.
Câteva exemple de săpunuri:
- săpunuri solide: stearatul de sodiu (CH3–(CH2)16–COONa; n = 18), palmitatul de sodiu (CH3–(CH2)14–COONa; n = 16)
- săpunuri moi: stearatul de potasiu (CH3–(CH2)16–COOK; n = 18), palmitatul de potasiu (CH3–(CH2)14–COOK; n = 16)
- săpunuri medicinale care conțin și substanțe antiseptice.
- sunt alcătuiți dintr-o catenă R– lungă nepolară, respectiv coada;
- au la o extremitate a cozii o grupă polară, –COO-, denumită cap sau grupă de cap;
- au un caracter dublu: polar și nepolar, care le asigură capacitatea de spălare.
Componentele anionului prezintă următoarele caracteristici:
- coada sau partea de catenă (radical hidrocarbonat) R– este nepolară, hidrofobă (hidrofob = care respinge apa); aceasta poate pătrunde în picăturile foarte mici de grăsime și în murdărie sau le poate înconjura, izolându-le.
- pe de altă parte, capul, reprezentat de grupa funcțională R–COO–, este polară, hidrofilă (hidrofil = care iubește apa) și rămâne la suprafața picăturilor foarte mici de grăsime sau a murdăriei.
Astfel, săpunul alcătuiește un ansamblu în care:
- prezintă o parte solubilă în apă, datorată legăturilor de hidrogen;
- prezintă o altă parte care se poate amesteca sau chiar solubiliza în grăsimi.
Deci, apa cu săpun adună și izolează grăsimile și murdăria din apă și de pe suporturile murdare, cu alte cuvinte, spală.
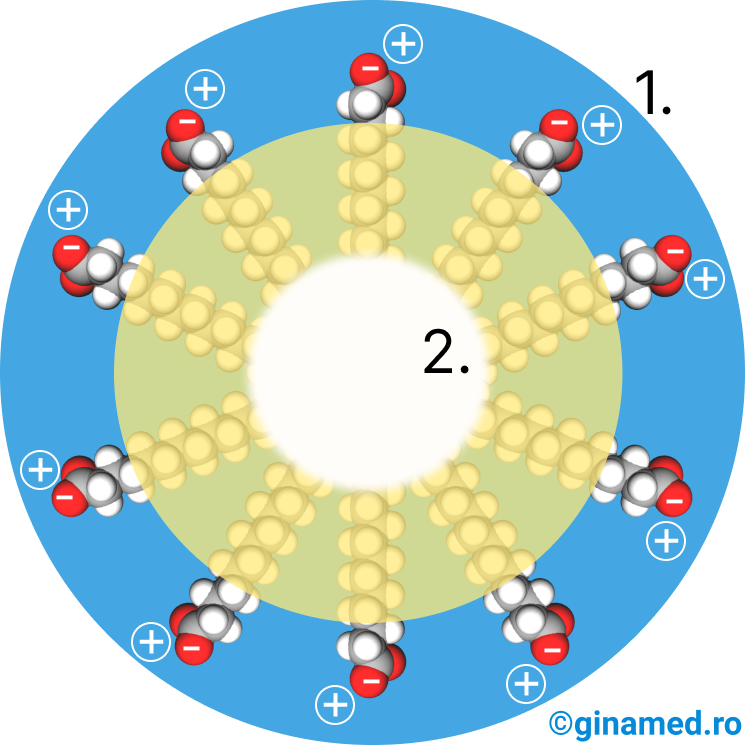
Moleculele ce prezintă un caracter dublu și pot fi hidrofobe și hidrofile, poartă numele de agenți activi de suprafață sau surfactanți. Această denumire este justificată de faptul că se acumulează și acționează la nivelul suprafețelor de contact.
Deci, săpunurile sunt agenți activi de suprafață (surfactanți), deoarece acționează la nivelul suprafeței care separă apa de grăsimi sau de murdărie.
Prin reacția de saponificare, care constă în hidroliza grăsimilor animale sau vegetale cu baze tari (NaOH sau KOH) - hidroliză bazică, se obțin săpunurile. În urma interacțiunii dintre grăsimi și soluții apoase de baze tari (NaOH sau KOH) se produce o reacție de hidroliză din care rezultă sărurile de sodiu sau de potasiu ale acizilor grași din compoziția grăsimii și se reformează glicerina.
Modul de preparare a săpunurilor: se amestecă grăsimile cu o soluție concentrată de hidroxid de sodiu (sodă caustică). Amestecul rezultat se fierbe la foc mic și după un interval de timp se adaugă sare de bucătărie (clorură de sodiu). După răcire rezultă un solid care este de fapt săpunul.
Săpunul se poate obține și prin neutralizarea cu hidroxid de sodiu (NaOH) a acizilor grași separați după hidroliza acidă a grăsimilor.
ACTIVITATE EXPERIMENTALĂ
Obținerea săpunului
Mod de lucru: Într-o capsulă de porțelan se aduc aproximativ 5 g de grăsime, peste care se pun aproximativ 20 de mL de soluție apoasă de NaOH 40% și se amestecă cu o spatulă sau o baghetă de sticlă. Amestecul de încălzește la flacăra unui bec de gaz și în timp ce fierbe, se amestecă și se adaugă apă distilată din când în când. Peste 30 de minute se verifică dacă saponificarea este completă testând dacă amestecul se solubilizează în apă. Se oprește încălzirea și se adaugă sub agitare peste amestec, 25 mL de soluție saturată caldă de NaCl. Se lasă la răcit amestecul și ulterior se separă săpunul solid de soluție.
Observații: prin acțiunea NaOH asupra unei grăsimi, la fierbere, se obține săpun.
Săpunurile se obțin ca urmare a acțiunii sodei caustice (NaOH) asupra grăsimilor animale, la fierbere, în gospodăria individuală dar și în industrie.
Detergenți
Detergenții sunt agenți activi de suprafață sau surfactanți de sinteză. Atât detergenții, cât și săpunurile prezintă modalități de acțiune similare.
Din punct de vedere structural, detergenții prezintă și ei:
- o grupă hidrofilă – capul;
- o parte hidrofobă, voluminoasă – coada.
Catenele din alcătuirea părții hidrofobe, pot fi:
- alifatice – radicali alchil, R–;
- aromatice – radical aril, Ar–;
- mixte – prezentând ambele tipuri de radicali.
Partea hidrofilă din molecula detergenților poate fi reprezentată de variate tipuri de grupe funcționale ionice sau neionice, dar care au capacitatea de a forma legături de hidrogen; în funcție de acestea, detergenții se clasifică în ionici și neionici.
În funcție de natura grupelor hidrofile, detergenții se clasifică în:
A. Detergenți ionici, care pot fi:
Detergenți anionici, pot conține:
- grupa funcțională acid sulfonic, –SO3H sub formă de sare, –SO3–Na+; astfel, sarea de sodiu a unui acid alchil sulfonic se scrie: R–SO3–Na+; sau ar mai putea fi sarea de sodiu a unui acid alchil-arilsulfonic (de exemplu, p-dodecilbenzensulfonat de sodiu).
- grupa funcțională a unor esteri ai acidului sulfuric (HO–SO3H); cu alcooli R–OH, denumiți sulfați acizi de alchil, R–O–SO3–H, sub formă de sare de sodiu, R–O–SO3–Na+;
Detergenți cationici:
- sunt săruri de amoniu cuaternar ale unor alchil-amine.
B. Detergenți neionici:
- polieteri, care prezintă în moleculă un număr mare (n = 10) de grupări etoxi, –CH2–CH2–O–; exemplu: polietoxietilen, R–O–(CH2–CH2–O–)nH;
În compoziția detergenților comerciali se mai întâlnesc diferiți aditivi care le atribuie proprietăți și calități superioare. Exemple de astfel de substanțe ar fi:
- substanțe fluorescente, care absorb razele UV și emit lumină în domeniul vizibil al spectrului, au scopul de a da senzația de strălucire și de o mai bună curățire a țesăturii;
- polifosfați, sunt ioni cu volum mare care înconjoară ionii de Ca2+ din apa dură și blochează interacțiunea acestora cu anionii de detergent, împiedicând precipitarea lor; fosfații constituie îngrășăminte chimice cu putere nutritivă mare, care determină dezvoltarea microorganismelor și a vegetației acvatice din apele poluate cu detergenți; în acest fel, fauna poate fi afectată sau chiar lacurile se pot transforma în mlaștini.
- anumite enzime, rezistente la condițiile din mașinile de spălat, pot modifica comportamentul proteinelor din murdărie, fără să afecteze fibrele din materialul de spălat.
Săpunurile sunt biodegradabile, însă detergenții nu (principalul lor dezavantaj), iar acest lucru constituie un pericol ecologic. În situația în care detergenții sunt deversați în râuri și lacuri, bacteriile nu au capacitatea de a distruge catenele lor ramificate și astfel, apele din natură se acoperă cu spumă. Acest pericol a fost înlăturat prin sintetizarea de detergenți cu molecule catene liniare, asupra cărora bacteriile pot acționa și le pot distruge în condiții aerobe. Aceștia sunt detergenții biodegradabili care manifestă o putere de spălare similară cu a izomerilor acestora cu catenă ramificată.
12.8. Grăsimi
Toate grăsimile constituie triesteri ai glicerinei cu acizi grași, cu alte cuvinte sunt trigliceride. Acestea se compun din:
- partea din glicerină (glicerol) și
- părțile rămase din acizii grași care prezintă catene lungi (radicali hidrocarbonați).
În funcție de tipul resturilor de acizi grași conținuți în moleculă, triesterii glicerinei se împart în:
- trigliceride simple – rezultă în urma reacției dintre glicerină și un singur tip de acid gras; exemple: 1,2,3-tributanoil-glicerol; 1,2,3-tristearil-glicerol (tristearină).
- trigliceride mixte – rezultă în urma reacției dintre glicerină și 2 sau 3 acizi grași diferiți; exemple: 1-palmitil-2-stearil-3-oleil-glicerol.
În condiții termice obișnuite (la temperatura ambiantă), grăsimile pot fi în stare solidă sau lichidă. De cele mai multe ori sunt denumite în mod curent „grăsimi”, compușii care sunt în stare solidă și „uleiuri”, compușii care sunt în stare fluidă. Diferența între grăsimi și uleiuri este dată de acizii grași de la care provin și a căror resturi intră în molecula de trigliceridă.
Materiile grase care se întâlnesc în stare naturală în organismele vii (plante și animale) constituie amestecuri cu compoziții variate de molecule de trigliceride ale unor acizi grași.
Grăsimi saturate
Tristearina constituie esterul triplu (triesterul) glicerinei care se obține prin reacția dintre o moleculă de glicerol (glicerină) și 3 molecule de acid stearic.
În stare naturală, în trigliceride, catenele de acid gras se înfășoară și se întrepătrund unele în altele și totodată și cu catene vecine, ceea ce duce la obținerea de structuri compacte. Conform acestor caracteristici structurale a grăsimilor saturate, se justifică starea lor solidă la temperatură ambiantă.
Proprietăți fizice ale grăsimilor saturate
ACTIVITATE EXPERIMENTALĂ
Mod de lucru:
b. Se aduce o cantitate mică de grăsime într-o lingură de ars sau într-o capsulă de porțelan. Se încălzește ușor la flacără până se topește și se lasă să se răcească. Să se remarce schimbările stării de agregare.
Observații:
a. Se observă că grăsimea nu se dizolvă în apă și plutește la suprafața acesteia; însă grăsimea se dizolvă în solvenți organici (în etanol, la încălzire);
b. La cald, grăsimea se topește, însă la răcire, se solidifică din nou.
Lipidele sunt substanțe naturale care se dizolvă în hidrocarburi și alcooli, însă nu se dizolvă (nu sunt solubile) în apă. Deci, și grăsimile sunt lipide.
Pornind de la structura moleculară a tristearinei, se pot intui proprietățile fizice ale grăsimilor saturate, cum ar fi:
- grăsimile nu pot forma legături de hidrogen deoarece lipsesc atomii de H legați de atomii de O; această caracteristică determină consecințe importante;
- nu sunt solubile în apă; din acest motiv, organismul are avantajul de a putea depozita molecule de grăsime, care să reprezinte rezerva sa energetică (de combustibil). Mai mult decât atât, nu solicită corpului locuri speciale pentru depozitare și funcționează totodată ca strat izolator. De exemplu, în cazul cămilei, în cocoașa acesteia sunt depozitate grăsimi ca rezervă de hrana și energie și totodată funcționează ca izolator termic.
- sunt solubile în solvenți organici nepolari, deoarece prezintă în moleculă catene voluminoase nepolare;
- densitatea grăsimilor este mai mică decât a apei, din acest motiv plutesc pe apă. Această caracteristică este justificată de prezența golurilor de aer care rămân între catene în structurile compacte; nu sunt strâns unite între ele.
- printr-o ușoară încălzire, grăsimile se topesc, iar prin răcire se solidifică.
- producția de grăsimi saturate are loc în corpurile animalelor, acumulându-se totodată la acest nivel. Prin topire, grăsimile animale pot fi separate de țesuturile la nivelul cărora se află. În timp și la temperatură ambientală, grăsimea topită devine solidă. Pentru consumul alimentar, grăsimile animale pot fi utilizate în mod direct, fără o prelucrare anterioară (fără a fi rafinate), deoarece puritatea lor este suficient de ridicată.
Grăsimi nesaturate
Grăsimile nesaturate sau uleiurile reprezintă triesteri ai glicerinei cu acizi grași. În molecula acestora se întâlnesc radicalii acid (R-CO-), proveniți de la acizi grași nesaturați.
Triacilglicerolii din uleiul de floarea soarelui conțin următoarele proporții de:
- 55-65% acid linolic;
- 33-36% acid oleic;
- 5-10% acizi palmitic și stearic.
Uleiul de măsline conține triacilgliceroli de tip acid oleic în proporție de 80%.
Grăsimile nesaturate pot adiționa iod. Indicele de iod reprezintă masa de iod, exprimată în grame, care se adiționează la 100 g de grăsime.
În molecula trigliceridei 1,2,3-trioleilglicerol, fiecare rest de acid gras prezintă o dublă legătură care influențează forma moleculei. Astfel, molecule din această trigliceridă nu se pot întrepătrunde și nu se pot tasa (comprima) atât de facil ca în cazul celor de tristearină, fiind în acest fel mai puțin compacte. Din acest motiv, grăsimile nesaturate, la temperatură ambientală, sunt în stare fluidă (sunt uleiuri) și nu se găsesc în stare solidă.
Acidul linoleic prezintă în moleculă 3 duble legături C=C, deci este un acid gras polinesaturat. Acidul linoleic formează esteri cu glicerina care sunt în stare lichidă și intră în compoziția uleiurilor vegetale, cum ar fi ulei de soia, ulei de porumb.
Polinesaturarea influențează grăsimile nesaturate, în sensul că:
- molecula de trigliceridă este mai rigidă (dacă se reduce nesaturarea grăsimilor);
- modifică reactivitatea chimică (crește rezistența la degradare oxidativă și crește temperatura de topire).
În urma contactului cu oxigenul din aer, legăturile duble din moleculele uleiului vegetal polinesaturat se rup (se scindează) și astfel se desfășoară o reacție de polimerizare. Acest fenomen se observă prin apariția unei pelicule la suprafața uleiului vegetal polinesaturat sau pe suprafața pe care este aplicat.
Având aceste proprietăți, uleiurile polinesaturate pot fi utilizate ca uleiuri sicative. În compoziția vopselelor în ulei intră un colorant de tip pigment, care se află în suspensie într-un ulei sicativ. Acest ulei sicativ poate fi uleiul de in completat de substanțe de umplutură, oxizi de metale și substanțe cu rol de catalizator.
În cazul în care se utilizează ulei pentru prăjit, sub acțiunea temperaturii crescute, ruperea legăturilor duble este accelerată. Astfel au loc reacții de oxidare cu oxigenul din aer ce duc la formarea de radicali liberi. Aceștia determină polimerizarea resturilor de acizi grași nesaturați din ulei, aspect care se remarcă prin apariția unui strat de consistență solidă care reprezintă produsul de polimerizare.
Radicalii liberi sunt compuși care dăunează puternic organismului uman. Motivele pentru care este recomandat să se evite adăugarea de ulei proaspăt peste un ulei utilizat deja la prăjit, sunt:
- radicalii liberi deja existenți favorizează polimerizarea uleiului deja introdus și se consumă mai repede;
- în acest fel crește concentrația de radicali liberi în preparatul respectiv și totodată și efectul dăunător asupra organismului.
Plantele constituie și ele o sursă de uleiuri, chiar dacă rezervele lor de hrană, sub formă de polizaharide, se află în tulpină, rădăcină, bulbi și frunze. Grăsimile din plante (uleiurile) se întâlnesc în majoritate în semințele și fructele acestora (de exemplu, măslin, avocado, floarea soarelui, soia, rapiță). Grăsimile au rol de rezervă de hrană utilizată în dezvoltarea și creșterea embrionului.
Prin presare se obțin uleiuri brute, care pentru a fi folosite în alimentație necesită proces de rafinare.
Reacția de hidrogenare prezintă o aplicație practică importantă în hidrogenarea grăsimilor vegetale și animale. Grăsimile vegetale care sunt în stare fluidă pot fi solidificate prin reacția de hidrogenare. Acest proces presupune saturarea resturilor de acizi grași nesaturați, prin adiția hidrogenului la dublele legături, C=C, rezultând grăsimi saturate de origine vegetală. Printr-un astfel de procedeu se obține margarina. Margarina sau untul vegetal este o emulsie de grăsimie vegetală, parțial hidrogentată în lapte, de obicei smântânit, cu adaos de vitamine, coloranți, conservanți, aromatizanți.
Totodată grăsimile hidrogentate constituie materii prime pentru obținerea săpunului, a unor detergenți, a stearinei, a unor unsori consistente.
Hidroliza grăsimilor
În procesul complex de metabolizare a grăsimilor în organismele vii, o etapă importantă o reprezintă hidroliza trigliceridelor din grăsimi. Aceste reacții sunt catalizate de enzime specifice. Enzimele sunt biocatalizatori și au rolul de a accelera procesele (reacțiile) biochimice. Enzimele sunt compuși organici produși de către celulele organismelor vii, animale sau vegetale.
Trigliceridele sunt hidrolizate de lipaze. În sucul pancreatic se întâlnesc lipaze în cantitate apreciabilă și asigură digestia intestinală a grăsimilor din alimente.
Lipaza pancreatică acționează în mod specific asupra grupelor esterice din pozițiile 1 și 3 din molecula trigliceridelor. Monogliceridele și acizii grași rezultați sunt absorbiți prin mucoasa intestinală. În mucoasa intestinală are loc un proces complex prin care trigliceridele sunt resintetizate din 2-monoacilgliceroli și acizi grași. Ulterior, din celulele intestinale, trigliceridele sunt preluate de limfă și pe cale sanguină sau limfatică ajung în țesuturi și celule, unde sunt implicate (antrenate) în procese anabolice și catabolice.
Catabolismul trigliceridelor debutează cu hidroliza lor, care constituie prima etapă ce are loc sub acțiunea lipazelor intracelulare, formând glicerol și acizi grași.
Importanța practică și acțiunea biologică a grăsimilor
Principalul rol al grăsimilor îl reprezintă funcția lor de rezervă de combustibil pentru organism. Prin oxidarea completă a lor din cursul arderilor din corp, din grăsimi rezultă dioxid de carbon și apă și o cantitate mare de energie care se eliberează.
Totodată, materiile grase din hrană înregistrează și alte funcții diferite.
Printre rolurile grăsimilor se numără:
- pot fi folosite ca solvent pentru multe substanțe care dau gust alimentelor, dar și pentru anumiți compuși care le dau culoare;
- au rol de unguent (lubrifiant) pentru firele de păr și piele, utilizate atât de oameni, cât și de animale;
- pun la dispoziție organismului carbonul din catenele lungi și flexibile ale grăsimilor saturate cu scopul de a obține colesterol; astfel, concentrația sa din plasma sanguină crește peste normal și se poate depune pe pereții vaselor de sânge, favorizând apariția anumitor boli cardiovasculare; cu toate acestea, colesterolul este indispensabil pentru buna funcționare a organismului;
- intervin în prepararea ciocolatei prin untul de cacao extras din boabele de cacao, în compoziția căruia intră trioleil-glicerol; acidul oleic conținut face ca ciocolata să se topească brusc la o temperatură apropiată de cea a corpului, respectiv la 34°C; această caracteristică asigură și calitatea ciocolatei;
- un amestec de grăsimi intră în compoziția laptelui care formează o emulsie cu apa în care grăsimile se găsesc disperate în picături de dimensiuni foarte mici.
12.9. Ceruri
Cerurile sunt compuși organici naturali. Acestea manifestă rol protector pe suprafața anumitor plante, fructe, frunze, pe care apar.
Chimic, cerurile sunt amestecuri în compoziția cărora intră:
- esteri ai acizilor monocarboxilici superiori (a căror număr de atomi de carbon variază între C23 – C34) cu alcooli superior (C24 – C34) cu număr par de atomi de carbon;
- alcooli superiori;
- parafine cu număr impar de atomi de carbon care variază între C25 – C34.
Despre întrebuințările anumitor ceruri:
- ceara de albine – este un amestec de esteri ai acizilor C24-C34 (în principal), cu acizi liberi și alcani C25-C31;
- ceara de spermanceti sau walratul – ceară izolată din grăsimea de cașalot (mamifer marin); în alcătuirea acesteia intră esterul acidului palmitic (C16) cu alcoolul cetilic (C16) și în mod special cu alcoolul oleic (C18); utilizările sale cuprind cosmetica și industria farmaceutică.
- lanolina – este extrasă din lâna de oaie cu ajutorul unor dizolvanți; lanolina este un amestec de esteri, alcooli și acizi liberi; prezintă o putere mare de emulsionare pentru apă, fiind utilizată pentru prepararea cremelor cosmetice și ca ingredient de bază pentru unguente în industria farmaceutică.
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

