10. Alcooli
Cuprins:
10.1. Scurt istoric10.2. Denumirea alcoolilor
10.3. Clasificarea alcoolilor
10.4. Structura alcoolilor
10.5. Proprietăți fizice
10.6. Reacții de obținere
10.7. Proprietăți chimice
10.8. Metanolul sau alcoolul metilic
10.9. Etanolul sau alcoolul etilic
10.10. Glicerina sau glicerol
10.11. Alți alcooli și utilizările acestora
10.1. Scurt istoric
Chimia este o știință strâns conectată de viața și activitățile oamenilor. Acest lucru a făcut ca în multe situații în care un anumit compus des utilizat în practică, să atribuie totodată numele său unei întregi clase de compuși. Un astfel de exemplu ar fi alcoolul etilic sau etanolul care a fost utilizat încă din antichitate și cunoscut drept „alcool” și de la care își are originea numele clasei de compuși organici – alcooli.
Alcool, din limba arabă, al Kohl = pudră fină, dar totodată are sens de esență a unui lucru. În mod specific, termenul face referire la lichidul rezultat din distilarea vinului – alcoolul, care constituie esența acestuia.
Încă din cele mai vechi timpuri, vinul a prezentat importanță pentru om, fiind cunoscut și utilizat. Acest lucru este justificat de frescele din piramide care redau procesul de obținere a vinului din struguri de către vechii egipteni încă din secolul al XV-lea î. Hr.
Alcoolii constituie o clasă de compuși organici care prezintă în moleculă o grupă hidroxil „–OH” legată de un atom de carbon implicat doar în formarea de legături simple σ (atom de carbon saturat).
Formula generală: R–OH
Poliolii sunt compuși care prezintă în moleculă mai multe grupe hidroxil legate de atomi de carbon saturați, câte una la un atom de carbon.
10.2. Denumirea alcoolilor
Un alcool se denumește prin adăugarea sufixului „-ol” la numele alcanului cu același număr de atomi de carbon.
Exemple de alcooli:
| metanol | etanol | glicerina |
|---|---|---|
| CH3–OH | CH3–CH2–OH |
În cazul alcoolilor care prezintă în moleculă 3 sau mai mulți atomi de carbon, este necesară precizarea poziției grupei hidroxil, „–OH”. Totodată, pentru alcoolii care prezintă în moleculă mai multe grupe „–OH”, este necesară precizarea numărului prin prefixul corespunzător: di-, tri-, etc.
Sunt unele situații în care se utilizează și o modalitate mai veche de formare a denumirii alcoolului, pornind de la cuvântul „alcool” urmat de numele radicalului hidrocarbonat, la care se adaugă sufixul „-ic”. De exemplu, metanol sau alcool metilic; etanol sau alcool etilic.
Sunt alcooli care prezintă și denumiri uzuale, cum ar fi:
- spirt alb (pentru etanol);
- glicol;
- glicerină.
10.3. Clasificarea alcoolilor
Criteriile de clasificare ale alcoolilor, sunt după:
- natura catenei hidrocarbonate: alcool aromatic, alcool saturat, alcool nesaturat.
- numărul de grupări hidroxil (–OH) din moleculă: alcool monohidroxilic, di-, tri-, etc.
- tipul de atom de carbon de care este legată gruparea hidroxil „–OH”.
În funcție de tipul de atom de carbon de care este legată gruparea hidroxil „–OH”, alcoolii se clasifică în:
- alcooli primari: grupa „–OH” este legată de un atom de carbon primar: R-CH2-OH;
- alcooli secundari: grupa „–OH” este legată de un atom de carbon secundar: R2CH-OH;
- alcooli terțiari: grupa „–OH” este legată de un atom de carbon terțiar: R3C-OH.
10.4. Structura alcoolilor
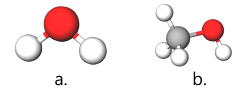
Conform datelor din tabelul periodic, electronegativitatea următorilor atomi crește în ordinea: H < C < O.
Legăturile C–O–H din alcooli sunt polare. Deoarece atomul de oxigen este mai atrăgător de electroni (completare: adică este mai electronegativ), pe acesta se găsește o densitate de sarcină negativă, față de atomii de hidrogen și carbon, unde apar densități de sarcină pozitivă. Această polarizare a moleculei de alcool favorizează apariția unor forțe de atracție electrostatică între atomul de hidrogen dintr-o grupă hidroxil „–OH” și atomul de oxigen al altei grupe.
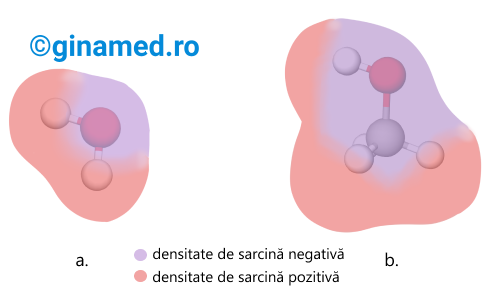
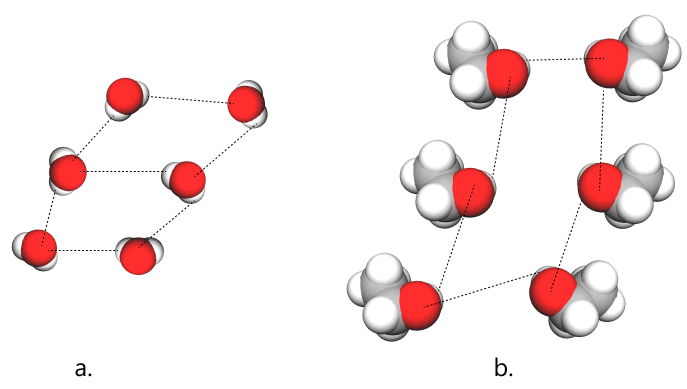
În acest fel, între moleculele de alcool se stabilesc interacții de natură fizică, denumite legături de hidrogen. Astfel, moleculele de alcool stabilesc legături de hidrogen:
- între ele;
- cu moleculele de apă;
- cu molecule ale altor compuși care prezintă atomi de oxigen.
10.5. Proprietăți fizice
În cazul alcoolilor inferiori, proprietățile fizice ale acestora sunt influențate într-o proporție mai mare de prezența în molecula a grupării hidroxil „–OH”, față de radicalul hidrocarbonat.
Moleculele asociate prin legături de hidrogen prezintă următoarele caracteristici:
- prezintă puncte de fierbere și de topire ridicare;
- au vâscozitate mare;
- au tensiunea de suprafață sau tensiunea superficială mare.
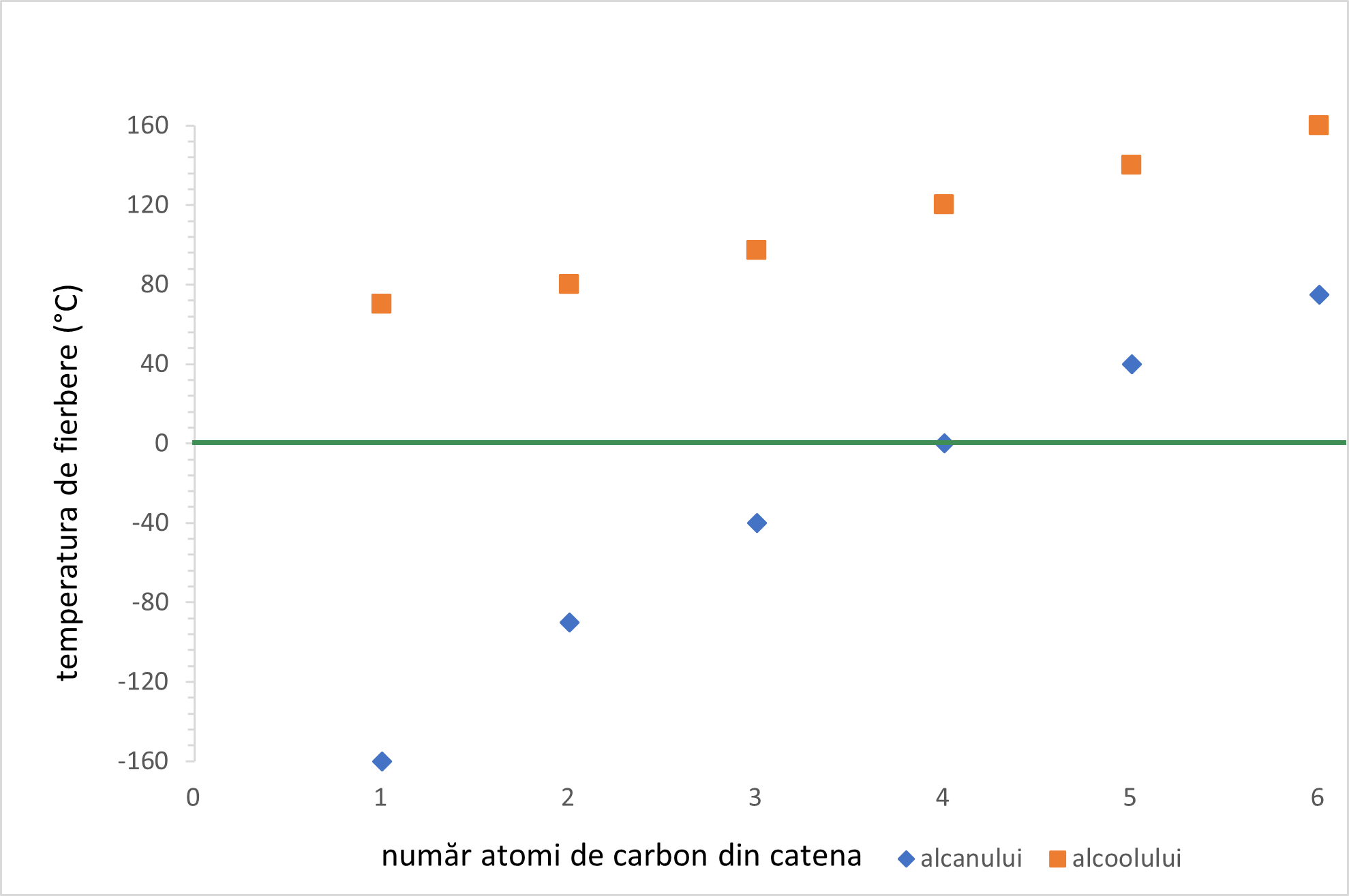
Alcooli care prezintă mase molare mici se numesc alcooli inferiori. Aceștia sunt lichizi. Exemple de alcooli inferiori: metanol, etanol, glicerină.
Alcoolii se caracterizează prin puncte de fierbere mai ridicate comparativ cu alcanii corespunzători, întregistrând valori ale punctelor de fierbere care cresc odată cu creșterea numărului de grupări hidroxil „–OH” din moleculă.
ACTIVITATE EXPERIMENTALĂ
Solubilitatea alcoolilor
Mod de lucru: Într-un stativ în care se află o serie de eprubete curate și uscate, în câte două se aduc compușii organici:
- parafină;
- etanol;
- glicerină.
- în prima eprubetă se aduce apa într-un volum aproximativ de 5 mL;
- în eprubeta a doua se aduce tetraclorură de carbon, CCl4 (solvent organic), într-un volum aproximativ de 5 mL.
Se agită fiecare eprubetă.
Observații: Sunt cuprinse în tabelul de mai jos.
| Nr. eprubetă | Substanța | Solvent | Observații | Concluzii |
|---|---|---|---|---|
| 1. | Parafină | H2O | Substanța solidă și apă. | Parafina nu se dizolvă în apă. |
| 2. | Parafină | CCl4 | Substanța solidă se dizolvă. | Parafina se dizolvă în CCl4. |
| 3. | Etanol | H2O | Nu se observă nicio modificare. | Etanolul se dizolvă în apă. |
| 4. | Etanol | CCl4 | Se formează două straturi de lichid. | Etanolul nu se dizolvă în CCl4. |
| 5. | Glicerină | H2O | Nu se observă nicio modificare. | Glicerina se dizolvă în apă. |
| 6. | Glicerină | CCl4 | Se formează două straturi de lichid. | Glicerina nu se dizolvă în CCl4. |
Alcoolii sunt ușor solubili în apă. Alcoolul metilic și etilic formează amestecuri omogene cu apa în orice proporție.
ACTIVITATE EXPERIMENTALĂ
Tensiunea superficială a alcoolilor
Mod de lucru: Într-un cilindru gradat sau într-o eprubetă se aduc etanol și într-un recipient similar, glicerină. Se analizează lichidul care curge. Se agită ușor eprubetele și se observă lichidul în contact cu pereții de sticlă.
Observații: Glicerina curge mai lent, comparativ cu etanolul; după agitare, glicerina întârzie pe pereții eprubetei; în ambele recipiente, alcoolii lichizi aderă de pereții vasului și formează un menisc datorită tensiunii de suprafață (tensiunii superficiale) mari.
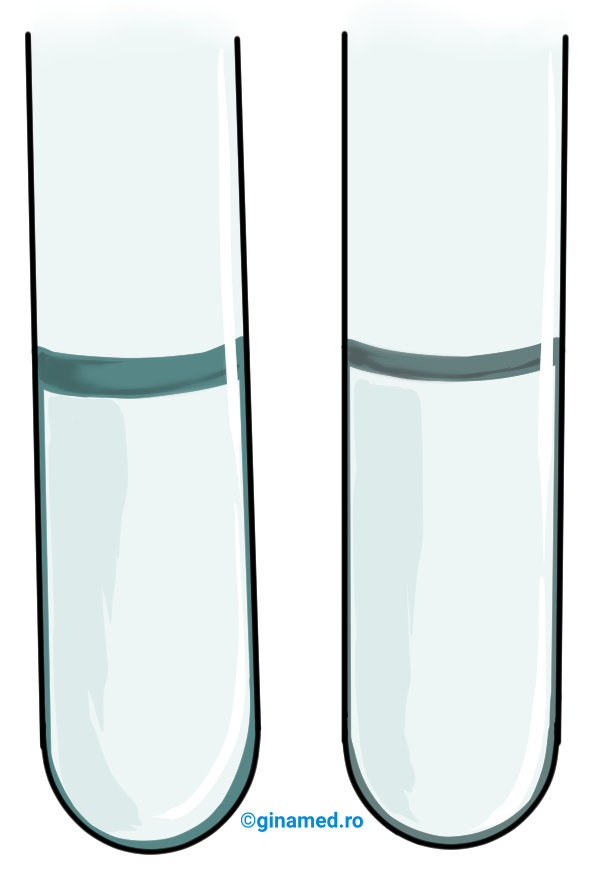
Glicerina este un alcool trihidroxilic (triol), deoarece în fiecare moleculă a acesteia se află 3 grupe hidroxil „–OH”. Acestea formează legături de hidrogen cu moleculele vecine. Coeziunea dintre molecule este mai mare în cazul glicerinei, comparativ cu etanolul.
Glicerina este mai vâscoasă și prezintă tensiune superficială mai mare față de etanol.
10.6. Reacții de obținere
Hidroliza derivaților halogenați
Condiții de reacție pentru hidroliza derivaților halogenați: soluție apoasă de baze tari (NaOH, KOH);
Observație: vor reacționa doar derivații halogenați care prezintă atomul de halogen legat de un atom de carbon saturat.
Compușii care rezultă în urma reacției de hidroliză depind de structura compusului halogenat.
Exemple de reacții de hidroliză ale unor compuși monohalogenați:
Observație:
În cazul în care derivații dihalogenați sunt vicinali, prin reacția de hidroliză se obțin dioli.
În cazul în care derivații trihalogenați sunt vicinali, prin reacția de hidroliză se obțin trioli.
În reacția de hidroliză a derivaților halogenați, aceștia prezintă reactivitate diferită și dependentă de structura acestora. Anumiți compuși hidrolizează la tratarea cu o soluție diluată de NaOH sau prin simpla fierbere cu exces de apă. Alți compuși hidrolizează doar în prezența unor soluții concentrate de hidroxizi alcalini.
Sunt compuși halogenați cu reactivitate scăzută acei compuși halogenați în care atomul de halogen este legat de un atom de carbon implicat într-o legătură dublă sau de un atom de carbon dintr-un nucleu benzenic.
Au reactivitate scăzută: clorura de vinil și clorura de fenil.
În anumite condiții speciale, unii compuși halogenați care prezintă reactivitate scăzută pot hidroliza.
Reducerea compușilor carbonilici
Condiții de reacție pentru reducerea compușilor carbonilici:
- H2 și catalizatori (Ni, Pt, Pd);
- hidruri complexe (LiAlH4, NaBH4) în soluție eterică;
- sistem donor de protoni și electroni (Na+C2H5–OH).
Primii 2 reactanți în prezența cărora poate avea loc reacția de reducere a compușilor carbonilici, sunt cei mai importanți. De cele mai multe ori, reacțiile de reducere cu hidruri complexe se desfășoară în condiții foarte blânde și cu randamente mari.
În urma reacțiilor de reducere:
- aldehidele se transformă în alcooli primari;
- cetonele se transformă în alcooli secundari.
Astfel, reducerea aldehidelor și cetonelor reprezintă o metodă importantă de obținere a alcoolilor primari și secundari.
Reducerea compușilor carbonilici nesaturați
Reducerea monozaharidelor
Aldozele sau cetozele conțin în moleculă o grupare carbonil. Prin reducerea lor cu hidrogen în prezență de Ni (nichel) sau cu amalgam de sodiu și acid, se obțin alcooli polihidroxilici. Prin reducerea hexozelor se obțin hexitoli.
Reducerea cetozelor transformă atomul de carbon din grupa carbonil în carbon asimetric, obținându-se astfel 2 alditoli izomeri care diferă între ei prin configurația acestui atom de carbon.
Oxidarea blândă a alchenelor
Reacția de oxidare blândă a alchenelor are loc în soluție apoasă neutră sau slab bazică de permanganat de potasiu (reactiv Bayer).
Acțiunea agentului oxidant rupe legătura π din legătura dublă a alchenelor și formează dioli. Diolii sunt compuși care prezintă două grupări hidroxil (–OH) la cel 2 atomi de carbon vecini (dioli vicinali). Prin ruperea legăturii π în cadrul acestei reacții, la fel ca și în reacția de adiție, rezultă un compus saturat stabil.
Adiția apei la alchene
În ceea ce privește alchenele nesimetrice, adiția apei se face conform regulii lui Markovnikov.
Rezultă un alcool secundar în care gruparea hidroxil (–OH) este legată de un atom de carbon secundar.
Obținerea metanolului din metan
Obținerea metanolului din gazul de sinteză
Gazul de sinteză este utilizat pentru sinteza de alcani superiori și alcool metilic (metanol). Hidrogenul poate fi utilizat pentru sinteza amoniacului și în alte scopuri.
Obținerea etanolului din glucoză
Prin fermentație alcoolică, glucoza se transformă în alcool etilic utilizat la prepararea băuturilor alcoolice.
Hidroliza alcoxizilor
Hidroliza acidă sau alcalină a esterilor
Hidroliza în mediu acid
Esterii sunt derivați funcționali ai acizilor carboxilici, prin a căror hidroliză conduc la acidul carboxilic de la care provin. Acest aspect este valabil pentru toți derivații funcționali ai acizilor carboxilici. Pe lângă refacerea acidului, în reacția de hidroliză a esterilor se mai obține și alcool.
Hidroliza esterilor în mediu acid este o reacție opusă reacției de esterificare și este o reacție reversibilă. Deplasarea echilibrului spre dreapta este favorizată de excesul de apă.
Hidroliza în mediu bazic
Hidroliza în mediu bazic a esterilor este o reacție ireversibilă. În urma reacției se obține sarea acidului carboxilic și alcoolul.
Condiții de reacție: prezența bazelor tari (NaOH, KOH).
Hidroliza triacilglicerolilor sau trigliceridelor
Triacilglicerolii sau trigliceridele sunt componentele principale din grăsimile naturale. Acești compuși prezintă în moleculă 3 grupe esterice care pot hidroliza în mediu acid și bazic.
Alchilarea cu oxid de etenă (etoxilare)
Etilenglicolul (1,2-etandiol) se utilizează la fabricarea polietilenteraftalatului (PET) și ca agent antigel.
10.7. Proprietăți chimice
Caracter acid
Alcoolii, împreună cu fenolii și acizii carboxilici sunt compuși care manifestă caracter acid. Acesta este dat de grupa –OH și prezintă variații în funcție de polaritatea legăturii O–H și de stabilitatea bazelor conjugate.
Conform experimentelor, aciditatea compușilor enumerați crește în ordinea: alcooli < fenoli < acizi carboxilici.
Deoarece alcoolii sunt acizi mai slabi decât apa, reacția metalelor alcaline cu alcoolii anhidri este mai puțin violentă, comparativ cu reacția metalelor cu apa.
Sistemul etanol – sodiu se folosește ca agent reducător pentru reducerea compușilor carbonilici la alcooli.
Alcoolații alcalini hidrolizează puternic în prezența apei.
Alcoolii NU reacționează cu hidroxizii.
Oxidarea blândă a alcoolilor (cu K2Cr2O7/H2SO4)
Soluția de dicromat de potasiu acidulată cu acid sulfuric nu scindează (nu rupe) moleculele alcoolilor. În prezența acestei soluții oxidante, alcoolii primari se oxidează la aldehide.
Prin oxidarea blândă a alcoolilor primari, rezultă aldehide, iar prin oxidarea alcoolilor secundari, se formează cetone.
ACTIVITATE EXPERIMENTALĂ
Oxidarea blândă a etanolului
Se transferă apoi substratul organic într-o altă eprubetă, se adaugă 1-2 mL de soluție Tollens și se încălzește pe baie de apă.
Reacția de oxidare blândă a alcoolilor se poate desfășura și în prezență de Cu (cupru) (catalitic, prin dehidrogenare), prin încălzire (t°C), rezultând compuși carbonilici, conform schemei generale:
Oxidarea energică a alcoolilor primari (cu KMnO4/H2SO4)
Oxidarea alcoolului etilic la acid acetic poate să aibă loc și sub acțiunea unor enzime (fermentația acetică), în urma căreia se obține oțetul alimentar din vin (oțetirea vinului).
ACTIVITATE EXPERIMENTALĂ
Oxidarea energică a etanolului
Deshidratarea alcoolilor
Deshidratarea alcoolilor mai poate fi denumită și deshidratare intramoleculară.
ACTIVITATE EXPERIMENTALĂ
Obținerea etenei
![Instalația pentru obținerea etenei. Pe imagine se observă utilizarea unui balon cu fund plat dar se poate folosi și o eprubetă. În eprubeta din dreapta se aduc pe rând, separat în câte o eprubetă, soluție de [HTML]Br<sub>2</sub>[/HTML] în apă sau într-un solvent organic ([HTML]CCl<sub>4</sub>[/HTML]) de culoare brun-roșcată și soluție violetă de [HTML]KMnO<sub>4</sub>[/HTML].](/content/image-upload/intalatie_obtinere_etena_chimie.png)
- soluție de Br2 în apă sau într-un solvent organic (CCl4), aproximativ 2-3 mL sau
- 2 mL soluție KMnO4 0,5% și 2 mL soluție Na2CO3 0,5%.
Alcoolii superiori, pot fi și ei supuși deshidratării iar în acest caz se formează majoritar alchena cea mai substituită.
Reacția de alchilare a arenelor cu alcooli
Alchilarea alcoolilor cu oxid de etenă
Etoxilarea alcoolilor inferiori
Condiții de reacție pentru etoxilarea alcoolilor inferiori:
- temperatură 150°C;
- presiune 17-18 atm.
În urma reacției de etoxilare se pot obține:
- monoeteri ai glicolului, HO-CH2-CH2-O-R, care tehnic se numesc celosolvi; sau
- monoeteri ai dietilenglicolului, HO-CH2-CH2-O-CH2-CH2-OR, care tehnic se numesc carbitoli.
Celosolvii și carbitolii sunt solvenți foarte buni, care sunt utilizați în industria de lacuri și vopsele, în special pe bază de nitroceluloză, în vopsitorie, în industria textilă, în cosmetică și altele.
Polietoxilarea alcoolilor grași
Condiții de reacție pentru polietoxilarea alcoolilor grași:
- temperatură 170°C;
- presiune 3,5 atm.
În urma acțiunii oxidului de etenă asupra alcoolilor grași, se formează produși polietoxilați, care poartă numele de alchilpoliglicoeteri.
Dependent de raportul molar oxid de etenă : alcool gras, se formează produși cu diferite grade de etoxilare.
Moleculele alcoolilor grași polietoxilați sunt substanțe tensioactive, deoarece conțin în moleculă două grupe cu afinități diferite față de apă.
În polietoxilare pot să fie implicați și alcooli nesaturați.
Atomii de oxigen eterici pot să realizeze legături de hidrogen cu moleculele de apă, deci grupa polieterică este o grupă hidrofilă.
Gradul de etoxilare depinde de domeniul de utilizare a compusului polietoxilat. Se notează numărul de atomi de carbon din restul hidrofob cu „n”. În acest fel se folosește gradul de etoxilare:
- redus: n/3, pentru obținerea de emulgatori în industria textilă;
- mediu: n/2, pentru spălatul lânii și ca agent de umectare;
- mare: de la 1-1,5n; în detergenții pentru rufe fine.
Astfel, alcooli grași polietoxilați sunt folosiți ca emulgatori, detergenți neionici, agenți de umectare, agenți de dispersie și altele. Compușii polietoxilați se întâlnesc în compoziția a numeroase produse cosmetice și de uz casnic, cum ar fi: creme, unguente, șampon, detergenți pentru rufe, vase de bucătărie, geamuri, covoare și altele.
Reacția de esterificare
Reacțiile de esterificare sunt reacții reversibile (în mediu acid).
Alcoolii pot să formeze esteri în reacție cu clorurile acide sau anhidridele acizilor carboxilici. Aceste reacții sunt totale, nu mai sunt reversibile.
Condensarea alcoolilor hidroxibenzilici
Alcoolii o-hidroxibenzilic și p-hidroxibenzilic, obținuți în urma reacției dintre fenol și formaldehidă în cataliză bazică (NaOH) și la rece, conduc prin încălzire la 150°C la policondensare cu formarea de resită (bacheltă C).
Descoperirea bachelitei se atribuie chimistului belgian emigrat în Statele Unite, Leo Hendrik Baekeland, în anul 1909.
Resita (bachelita C) prezintă molecule tridimensionale în alcătuirea cărora intră nuclee fenolice condensate în toate cele 3 poziții active (o, o’, p). Este un compus termorigid și insolubil.
Datorită rezistenței mecanice și chimice mari, precum și proprietăților electroizolante, rășinile de bachelită se folosesc la obținerea izolatorilor electrici, în construcții (cască de protecție, cabluri), în construcția de mașini și altele.
Eterificarea alcoolilor cu CH3–I
Sunt alcooli cu importanță practică: metanol, etanol, glicerină, dar și alții.
Obținerea butadienei prin metoda Lebedev
10.8. Metanolul sau alcoolul metilic
Altă denumire: alcool de lemn – deoarece a fost obținut pentru prima dată din lemn, prin distilare.
În cantități extrem de mici (la nivel de „urme”), metanolul de găsește în:
- fumul rezultat prin arderea lemnelor;
- vinul nou – contribuie la „buchetul” acestuia.
Metanolul poate fi obținut industrial prin două metode – chimizarea metanului. Ne reamintit din cursul de Alcani:
Proprietăți fizice ale metanolului
Proprietățile fizice ale metanolului sunt:
- este un lichid incolor, volatil;
- prezintă un miros ușor dulceag, care se aseamănă foarte mult cu etanolul;
- foarte ușor solubil în apă și alți alcooli;
- se amestecă perfect cu apă și cu etanolul, în orice proporție;
- datorită acestor proprietăți, se poate confunda cu ușurință cu etanolul, existând un pericol de intoxicație.
Acțiunea biologică a metanolului
Asupra organismului uman, alcoolul metilic prezintă efect toxic. Nu este încadrat ca fiind o otravă, însă prezintă o acțiune extrem de nocivă, în mod indirect. Toxicitatea este dată de transformarea sa în compuși toxici odată cu introducerea sa în corp. Compușii toxici sunt:
- aldehida formică, și
- acidul formic, – din limba latină, formica = furnică. Acest compus intră în compoziția veninului injectat de furnici și de unele omizi.
Aceștia rezultă ca urmare a acțiunii enzimei alcool dehidrogenaza produsă de către corpul omenesc. Compușii toxici odată rezultați, în funcție de cantitate determină următoarele:
- în cantitate mică, acționează asupra celulelor retinei, atacându-le și provocând degenerarea nervului optic care determină orbire;
- în cantitate mare, determină moartea.
Doza letală pentru om: aproximativ 0,15 g/kg corp.
Arderea metanolului
Metanolul este foarte inflamabil și arde cu o flacără albastră-deschis, aproape invizibilă.

În urma reacției de ardere, metanolul se transformă în dioxid de carbon și apă.
Cu toate că prezintă multiple avantaje, cum ar fi:
- prezintă putere calorică mare (aproximativ 7000 kcal/kg);
- formează produși de reacție nepoluanți pentru atmosferă;
- poate fi obținut și pe cale industrială;
Metanolul nu este utilizat în prezent ca și combustibil datorită acțiunii sale toxice. Alcoolul metilic rămâne o variantă alternativă de utilizare a benzinei și o variantă de combustibil pentru viitor.
Aplicații practice ale metanolului
Metanolul este utilizat în mod practic drept:
- solvent și combustibil, dar din ce în ce mai rar deoarece este toxic;
- materie primă pentru sinteza altor compuși organici (formaldehidă, esteri metilici, etc) folosiți pentru sinteza de mase plastice, coloranți, rășini sintetice, etc;
- solvent pentru grăsimi, lacuri, vopsele;
- uneori este folosit drept combustibil.
10.9. Etanolul sau alcoolul etilic
Oamenii îl definesc prin numele de „alcool”. O altă denumire a sa ar mai fi „spirt alb”, în limba latină „spiritus” = spirt. Încă din antichitate și până în prezent, etanolul reprezintă componenta esențială din toate băuturile alcoolice.
Încă din cele mai vechi timpuri și până în prezent, metoda de obținere a etanolului, cuprinde fermentația alcoolică a compușilor dulci (zaharidelor) din fructe (cum ar fi mere, struguri, etc.) sau din melasă, deșeu rezultat în urma fabricării zahărului. Procesul de fermentație alcoolică are loc sub acțiunea unor ciuperci, Saccharomyces cerevisiae care este prezentă în drojdia de bere.
O altă materie primă care se poate folosi pentru obținerea alcoolului ar fi și produsele cu un conținut bogat în amidon, cum ar fi cereale (grâu, orez, orz, porumb) sau legume (cartofi, sfeclă), însă acestea nu sunt supuse direct procesului de fermentație alcoolică. Aceste materii prime trebuie expuse unei prelucrări preliminare din care să rezulte compuși fermentabili.
Prin fermentația alcoolică se obține o soluție apoasă ce prezintă alcool în concentrație de 12-18% și alți compuși chimici. De exemplu, în compoziția vinului de masă, doar o moleculă din 20 este de etanol, restul fiind moleculele altor compuși (în care în majoritate sunt de apă).
Pentru a obține soluții apoase cu concentrații mai mari de etanol, soluțiile inițiale se supun procesului de distilare. Astfel, se pot obține soluții de etanol de concentrație 95-96%. Etanolul care nu conține apă se numește etanol anhidru. Acesta rezultă prin acțiunea unor reactivi avizi (lipsiți) de apă asupra etanolului concentrat.
Conținutul de alcool variază în vin, bere și alte băuturi alcoolice. Acesta este menționat pe etichetă prin grade alcoolice care sunt un echivalent al procentului (%) în volum de etanol conținut în băutura respectivă.
Etanolul poate fi obținut industrial din etenă prin adiția de apă, în prezență de acid sulfuric concentrat.
Acțiunea biologică a etanolului
Asupra organismului, etanolul acționează în mod:
- direct;
- indirect – prin intermediul compușilor în care se transformă ca urmare a acțiunii enzimelor (pe cale enzimatică).
Din punct de vedere fiziologic, etanolul prezintă acțiune depresivă și acționează ca un anestezic. Prezența alcoolului în organism este percepută de către persoanele care au consumat alcool, ca fiind un stimulent. Însă, în realitate, alcoolul își manifestă acțiunea la nivelul celulelor nervoase într-un mod similar medicamentelor care prezintă acțiune sedativă și tranchilizantă (Completare: sedativ - induce o stare de calm, liniștire a stărilor de excitație psihică sau motorie; tranchilizant - diminuează un exces de activitate psihică). Administrarea acestor tipuri de medicamente împreună cu băuturi alcoolice poate duce la moarte.
![În eprubeta din stânga se află etanol, iar în eprubeta din dreapta se află etanol și soluție de [HTML]K<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub>[/HTML]. Se observă cum culoarea portocalie a soluției de [HTML]K<sub>2</sub>Cr<sub>2</sub>O<sub>7</sub>[/HTML] se schimbă în verde, deoarece se formează soluția de clorură de crom (III) care este verde.](/content/image-upload/dicromat_alcool_chimie.png)
Alte efecte fiziologice determinate de prezența etanolului în organism, sunt:
- este stimulată producția unor hormoni diuretici, care favorizează secreția de apă și de urină, determinând o senzație de deshidratare;
- determină vasodilatație (dilatarea vaselor de sânge), crescând fluxul de sânge prin vasele capilare subcutanate; acest proces favorizează înroșirea anumitor porțiuni ale pielii și declanșarea senzației de căldură.
În cantități reduse, băuturile alcoolice pot funcționa ca un stimulator al SNC (sistemului nervos central) și al sistemului circulator. Însă, consumul în cantități mari și/sau pe o perioadă mai lungă de timp este toxic și determină dependență.
Intoxicația cu alcool duce la demență etilică și poate provoca moartea.
Persoanelor care au consumat sau au inhalat metanol, li se administrează ca antidot alcool etilic. Enzima din organism, alcool dehidrogenaza, acționează asupra etanolului, iar metanolul rămâne netransformat și se elimină din corp.
Aplicații practice ale etanolului
Aplicațiile practice ale etanolului vizează variate domenii de activitate, fiind utilizat:
- ca dezinfectant – sub formă de soluție apoasă în compoziția căreia se pot întâlni sau nu, alți compuși: coloranți, parfum; numele sub care este comercializat este de alcool/ spirt medicinal/ sanitar;
- drept compus de bază în prepararea băuturilor alcoolice și a esențelor;
- pentru sinteza de medicamente și la prepararea unor soluții utilizate ca medicamente;
- drept solvent în fabricarea lacurilor și vopselelor sau sub denumirea de alcool (spirt) tehnic;
- în industria parfumurilor;
- drept conservant pentru preparate biologice;
- ca lichid în anumite tipuri de termometre utilizate la temperaturi mai mici de +78°C, deoarece aceste este punctul de fierbere al etanolului; pentru a fi utilizat în acest fel, se colorează în roșu prin dizolvarea unui colorant, cel mai adesea roșu;
- drept combustibil – de exemplu, în spirtierele utilizate în unele laboratoare de chimie;
- ca materie primă pentru sinteza unor compuși organici.
10.10. Glicerina sau glicerol
Triolul 1,2,3-propantriol este denumit uzual glicerină. Caracteristicile sale, sunt:
- este un lichid incolor;
- nu are miros;
- are gust dulce;
- are vâscozitate mare;
- este ușor solubilă în apă și alcool.
Aplicațiile practice ale glicerinei
Cele mai importante aplicații practice ale glicerinei pot fi împărțite în două categorii:
- utilizări (întrebuințări) care se bazează pe capacitatea mare a glicerinei de a forma legături de hidrogen;
- utilizări (întrebuințări) care se bazează pe proprietățile chimice ale glicerinei.
- intră în alcătuirea unor soluții farmaceutice de uz extern (având rol antiseptic și calmant), a unor produse cosmetice (prezintă acțiune emolientă, catifelează pielea și împiedică uscarea acesteia) și în pastele de dinți (împiedică uscarea);
- se adaugă în compoziția bomboanelor cu scopul de a nu permite procesul de cristalizare a zahărului;
- se distribuie pe frunzele de tutun pentru a nu permite încrețirea lor și se adaugă chiar și în tutun pentru a menține umiditatea;
- se încorporează în anumite mase plastice cu scopul de le menține plasticitatea, deoarece funcționează ca un lubrifiant între moleculele de polimeri;
- este un compus de valoare al vinurilor de calitate, deoarece contribuie la gustul dulce și catifelat, datorită vâscozității; datorită prezenței glicerolului, prin agitarea ușoară a paharului de vin, se formează un strat care aderă la pereții paharului; acest lucru se datorează vâscozității mărite prin prezența glicerolului și care totodată face ca vinul să se scurgă mai lent de pe pereții paharului de sticlă. Acest fenomen este și un indiciu al calității;
- poate fi utilizată ca lichid în termometrele folosite la temperaturi mai mici de +290°C, care este temperatura de fierbere a glicerinei.
Utilizări (întrebuințări) care se bazează pe proprietățile chimice ale glicerinei:
- este componentul de bază din grăsimi, din care se și obține la fabricarea săpunurilor;
- este utilizată ca materie primă pentru obținerea unor rășini sintetice;
- constituie materia primă de bază pentru fabricarea (obținerea) trinitratului de glicerină.
Alte utilizări ale glicerolului:
- în cosmetică este utilizat ca și dizolvant;
- este folosit în medicină;
- este folosit la fabricarea dinamitei;
- prin deshidratarea sa, se obține acroleina: CH2=CH–CH=O;
- este utilizat la fabricarea lichidelor antigel.
Trinitratul de glicerină (TNG)
TNG sau trinitratul de glicerină se caracterizează prin:
- este un lichid uleios, incolor;
- explodează foarte ușor;
- sub denumirea de nitroglicerină, TNG este utilizat ca medicament în boli de inimă;
- având un conținut mare de oxigen în moleculă, se descompune și prin autooxidare;
- orice șoc mecanic de intensitate mică acționează asupra moleculei de TNG, o deformează, astfel încât atomii de C, H și O își pot schimba partenerii și duc la formarea unui număr foarte mare de molecule în stare gazoasă.
După cum se observă, în urma reacției rezultă doar gaze, ceea ce determină o creștere bruscă și foarte mare de volum (împreună cu degajarea unei cantități mari de energie), practic un nor gazos în expansiune rapidă, care reprezintă explozia.
Explozia trinitratului de glicerină cauzată de șocuri, lovituri sau frecări, poate fi împiedicată prin „diluarea” sau amestecarea TNG cu un material anorganic inert – silicatul natural kiselgur – obținându-se astfel, dinamita. În dinamită se introduce o capsă care conține fulminat de mercur cu ajutorul căreia se provoacă explozia dinamitei doar prin detonare, la nevoie. În dinamita fabricată în zilele noastre, în locul kiselgurului se folosește un amestec de materiale organice și anorganice.
Chimistul suedez Alfred Bernhard Nobel (1833-1896) este cel care a inventat dinamita în anul 1867. Invențiile sale au fost valorificate financiar, crescând averea chimistului, dar însoțit de conștiința dezastrelor și victimelor pe care le poate provoca utilizarea dinamitei în scopuri nepașnice, Alfred Nobel a decis să instituie la finalul vieții, premiul care îi poartă numele. Premiul Nobel a fost acordat pentru prima dată în anul 1909. Acest premiu reprezintă cea mai înaltă distincție acordată în lumea științifică și literară și care presupune acordarea unei sume importante de bani. Întreaga avere a lui Alfred Nobel reprezintă baza fondurilor acordate pentru acest premiu, care a crescut an de an prin investițiile făcute. Acordarea premiului Nobel are loc anual, pentru: chimie, fizică, medicină, literatură și pace.
Atât alcoolul etilic, cât și glicerina pot fi folosiți pentru obținere unor preparate farmaceutice, cum ar fi gemoderivatele și tincturile (Completare: tinctura este un medicament obținut prin dizolvarea în alcool sau eter a unor părți active din plante sau dintr-un compus chimic). Gemoterapia constituie o metodă de terapie naturistă, care susține detoxifierea organismului și refacerea țesuturilor afectate de boală, folosind extracte glicerinice sau gliceroalcoolice obținute din muguri sau alte țesuturi recoltate de la plantele în creștere.
10.11. Alți alcooli și utilizările acestora
Completare: informațiile de mai jos nu se găsesc în bibliografia indicată la finalul cursului, dar sunt informații necesare pentru rezolvarea unor grile din cărți de grile.
Oxidarea energică a metanolului
Deshidratarea INTERmoleculară a alcoolilor
Reacția alcoolilor cu acid sulfuric (H2SO4)
Bibliografie:
- Chimie - manual pentru clasa a X-a; Autori: Luminița Vlădescu, Corneliu Tărăbășanu - Mihăilă, Luminița Irinel Doicin. Grup Editorial ART, București, 2005
- Chimie C1 - manual pentru clasa a XI-a; Autori: Elena Alexandrescu, Viorica Zaharia, Mariana Nedelcu. Editura LVS Crepuscul, colecția Educațional, Ploiești, 2006

